 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Корозія металів. Методи захисту металів від корозії
|
|
Корозією називається самочинний процес руйнування металів і сплавів внаслідок фізико-хімічної взаємодії їх з навколишнім середовищем.
Корозія металів є гетерогенним процесом, у якому хімічні й електрохі-мічні процеси відбуваються на межі поділу двох фаз — метал і зовнішнє сере-довище.
Більшість металів є термодинамічно стійкими в окисненому вигляді. В цьому стані метали є позитивно зарядженими іонами, які входять до складу хімічних сполук. У процесі добування металів їх переводять з хімічних сполук у нейтральні атоми, тобто в термодинамічно нестійкі утворення (енергія Гіббса ΔG > 0).
Men+ + ne® Me° (DG > 0).
Таким чином, основною причиною корозії є термодинамічна нестійкість металів, внаслідок чого вони прагнуть перейти в окиснений стан, тобто віддати електрони
.

У результаті цієї реакції утворюються катіони металів, що призводить до фізич-ного руйнування металів. Чим більш термодинамічно нестійким є метал, тобто чим менша алгебраїчна величина його стандартного електродного потенціалу, тим легше він віддає електрони, тим більшою мірою він схильний до корозії.
Корозія може відбуватися в будь-якому середовищі: воді (річній, мор-ській, грунтовій), розчинах електролітів, газах, органічних розчинниках.
Залежно від механізму процесу розрізняють хімічну та електрохімічну корозію.
Хімічна корозія — це руйнування металу внаслідок взаємодії з середо-вищем, яке не проводить електричний струм. Хімічна корозія розвивається при контакті металу з розчинами неелектролітів або з газами при високих темпе-ратурах (її називають також газовою корозією). Під час хімічної корозії відбу-вається безпосереднє окиснення металу окисниками — компонентами навко-лишнього середовища (кисень О2, водяна пара, оксид вуглецю (IV) CO2, оксид сірки (IV) SO2). Наприклад, корозійне руйнування заліза та його сплавів в атмосфері кисню зумовлене перебігом реакції
4 Fe + 3 O2 ® 2 Fe2 O3.
Електрохімічною корозією називається процес руйнування металу в середовищі електроліту, який супроводжується виникненням електрорушійної сили на поверхні поділу фаз і електричного струму всередині системи. Електрохімічна корозія виникає при контакті металів, які мають різні електрод-ні потенціали за даних умов, або під дією зовнішнього електричного струму (руйнування підземних комунікацій блукаючими струмами), або ударною дією корозійного середовища (наприклад, руйнування гребних гвинтів суден).
Під час електрохімічної корозії на металі відбуваються одночасно два процеси:
окиснення металу, тобто його розчинення (анодний процес)
 ;
;
відновлення окисників ― компонентів середовища (катодний процес)

де Ox, Red — відповідно окиснена та відновлена форми речовини.
Окисниками у водних розчинах у кислому середовищі є іони водню Н+, у нейтральному та лужному середовищах - розчинений у воді кисень повітря  хлор
хлор  іони
іони 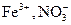 та інші. Так, корозія в кислому середовищі супроводжується таким катодним процесом:
та інші. Так, корозія в кислому середовищі супроводжується таким катодним процесом:
 .
.
Катодний процес під час корозії за участю кисню в нейтральному та лужному середовищах відбувається за рівнянням
 .
.
Процеси, що відбуваються під час електрохімічної корозії металів, мають той самий характер, що й при роботі гальванічних елементів. На анодних ділянках спостерігається руйнування металу, а на катодних — відновлення корозійноактивних речовин зовнішнього середовища і тому метал зберігає свою цілісність.
Наприклад, розглянемо корозію алюмінієвого листа з мідними гвинта-ми в кислому середовищі (рис. 25).

Рис. 25. Схема електрохімічної корозії алюмінію при pH<7
У даному випадку алюміній є анодом, оскільки має менше значення стандартного електродного потенціалу ( =-1,66В), а мідь (
=-1,66В), а мідь ( =+0,34B) — катодом. При цьому відбуваються такі реакції:
=+0,34B) — катодом. При цьому відбуваються такі реакції:
на аноді:  ;
;
на катоді:  .
.
У результаті алюміній руйнується в місці контакту, а на міді виділяється водень.
У нейтральному і лужному середовищах (рН ≥ 7) корозія відбувається за рівняннями реакцій:
на аноді: Al - 3e®Al3+;
на катоді: O2 + 2H 2O + 4e→4OH-;
у розчині: Al3++ 3OH-®Al (OH)3 ¯.
Методи захисту металів від корозії. Для запобігання корозії вико-ристовується комплекс протикорозійних заходів, який охоплює захист мета-левої поверхні різними методами. Методи захисту металів від корозії дуже різноманітні. Їх можна поділити на такі групи: методи дії на метал, електро-хімічні методи, методи дії на корозійне середовище.
Методи дії на метал. Для поліпшення властивостей металів, у тому числі для забезпечення їхньої корозійної стійкості, до складу сплавів вводять різні речовини, які переводять поверхню сплаву в пасивний стан. Так, корозійну стійкість сталі можна підвищити введенням хрому, нікелю, молібдену, вольфраму. Корозійна стійкість міді зростає при додаванні берилію.
У процесі корозії на поверхні металів утворюються плівки з продуктів корозії, які найчастіше є оксидами цих металів. Якщо плівки пористі, з поганою адгезією до металу, то вони не виявляють захисних властивостей (наприклад, продукт корозії заліза). На таких металах як Тa, Nb, Al, Ti, Sr утворюються дуже щільні безпористі плівки, які мають захисні властивості та запобігають корозії цих металів. Тому ці термодинамічно нестійкі метали проявляють до-сить високу корозійну стійкість. Таке явище називають пасивацією металу.
Можна свідомо переводити метали в пасивний стан (пасивація). Речо-вини, які переводять метал у пасивний стан, називають пасиваторами. До них належать HNO3, HNO2, H2O2, K2Cr2O7, O2.
Для захисту металів від корозії використовують також нанесення захис-них покрить. Захисні покриття поділяють на неорганічні (метали і неметали) та органічні.
Усі металеві покриття залежно від співвідношення значень електродних потенціалів основного та покривного металів поділяють на катодні та анодні.
Електродний потенціал катодних покрить повинен мати більш пози-тивне значення, ніж потенціал основного металу. Для заліза такими покриттями можуть бути покриття з свинцю, нікелю, олова, міді, тобто з металів, які мають меншу активність, ніж залізо. У випадку порушення цілісності такого покриття виникає корозійний елемент, у якому покривний метал є катодом, а основний - анодом. Останній піддається корозійному руйнуванню. Для прикладу розглянемо корозію заліза з домішками нікелю в лужному середовищі:
j0 Fe2+/ Fe =-0.44B, j0 Ni2+/ Ni =-0.25B;
на аноді: Fe-2e®Fe2+;
на катоді: 2H2О+O2+4е ®4OH-;
у розчині: Fe2+ +2OH-®Fe (OH)2.
Під впливом кисню повітря окиснення Fe(OH)2 проходить далі за рівнянням реакції:
4 Fe(OH)2 + O2 + 2 H2O → 4 Fe(OH)3 ↓.
Електродний потенціал анодного покриття повинен бути негативнішим ніж потенціал основного металу. До таких покрить належать, наприклад, пок-риття заліза хромом, цинком, тобто більш активним металом, ніж залізо. В ут-вореному при порушенні покриття корозійному елементі покривний метал – анод, а основний — катод. Наприклад, у випадку оцинкованого заліза в кислому середовищі:
j0 Fe2+/ Fe =-0.44B, j0 Zn2+/ Zn = -0.76B,
на аноді: Zn-2e®Zn2+;
на катоді: 2H++2e®H2.
Катодні покриття захищають метали тільки механічно. В разі утворення тріщин або пор у покритті вони прискорюють руйнування основного металу. Анодні покриття захищають метали не тільки механічно, а й електрохімічно, тобто при порушенні покриття кородує метал покриття, а основний метал збері-гає свою цілісність доти, доки металеве покриття практично цілком розчи-ниться.
До неорганічних покрить належать також оксидні і фосфатні плівки, кислотостійкі та бетонні покриття.
Оксидні плівки нарощують на металах, схильних до пасивації, наприк-лад, на алюмінію, цинку, титані. Для цього використовують хімічний та електро-хімічний методи одержання плівок.
Хімічний метод полягає в обробці металу розчином, який містить аніони – окисники. Наприклад:  .
.
Електрохімічний метод передбачає одержання оксидних плівок на мета-лі, який використовується як анод електрохімічної ванни у відповідних елек-тролітах.
Фосфатні покриття використовують, головним чином, для захисту сталі. Деталі обробляють гарячим розчином гідрофосфатів марганцю (II), цинку, заліза (II), внаслідок чого на поверхні виробу утворюється захисна плівка з важкорозчинних фосфатів відповідних металів. Наприклад:
2Fe+Mn(H2PO4)2®Mn(FePO4)2¯+2H2;
2Fe+Fe(H2PO4)2®Fe(FePO4)2¯+2H2.
Фосфатування, поряд з гарячим цинкуванням, використовують для за-хисту від корозії закладних деталей у великопанельному будівництві.
До органічних покрить належать лакофарбові покриття, покриття з полі-мерних смол та інші.
Електрохімічні методи. Для захисту металевих конструкцій (обшивка кораблів, трубопроводи, кабелі) від морської і грунтової корозії до них приєднуються протектори — більш активні метали (тобто метали з більш негативним значенням стандартного електродного потенціалу). Це так званий протекторний захист. При такому способі захисту два метали утворюють електрохімічне коло і метал основного устаткування захищається за рахунок процесу окиснення (розчинення) протектора. Наприклад, вироби з заліза та його сплавів можна захищати протекторами з цинку або магнію.
Іншим видом електрохімічного захисту є катодний захист. Металеву поверхню, яку захищають, з’єднують з негативним полюсом джерела постій-ного струму, тобто вона є катодом. Позитивний полюс приєднують до іншого, допоміжного металу, який вміщують у те саме середовище, що й виріб, який захищають, наприклад у грунт. Поверхня основного металу буде захищеною (на ній відновлюватимуться окисники з навколишнього середовища), а допоміжний метал буде окиснюватися. Електрохімічні методи найчастіше використовуються для захисту стального устаткування від корозії в морській воді та грунті.
Методи дії на корозійне середовище. Обробку корозійного середовища з метою зменшення його агресивності доцільно проводити в обмеженому об’ємі.
Швидкість корозійного процесу залежить від концентрації іонів водню Н+ в кислому середовищі та кисню в нейтральному. Зменшити концентрацію іонів Н+ можна за допомогою вапна СаО або каустичної соди NaOH:
CaO + 2H+®H2O + Ca2+;
NaOH + H+®H2O + Na+.
Зменшити концентрацію кисню можна за допомогою деаерації, що дося-гається термічною обробкою рідини гострою парою, продуванням через розчин інертних газів, хімічним знекисненням, що передбачає введення в корозійне середовище відновників (Na2SO3, SO2):
2 Na2SO3+O2®2Na2SO4;
2SO2 + 2H2O+ O2®2H2SO4.
Швидкість корозії може бути зменшена завдяки введенню в корозійне середовище інгібіторів — речовин, введення яких в невеликій кількості в коро-зійне середовище значно зменшує швидкість корозії. Інгібітори адсорбуються на поверхні металу і тим самим запобігають перебігу корозійних процесів. Дея-кі інгібітори сприяють видаленню кисню (окисника) з робочого середовища, що також гальмує швидкість корозійного процесу. Наприклад, інгібіторами корозії є неорганічні (NaNO2, Na2Cr2O7 — анодні інгібітори) і органічні (уротропін, формальдегід, діетиламін — катодні інгібітори) речовини та різноманітні суміші речовин.
5.4. Електроліз
Електролізом називається окисно-відновний процес, який відбувається під дією постійного електричного струму на електродах, занурених у розчин або розплав електроліту. При електролізі відбувається перетворення електричної енергії в хімічну. На характер перебігу електродних процесів при електролізі великий вплив має склад електроліту, розчинник, матеріал електродів і режим електролізу (напруга, густина струму, температура та ін.).
Електроліз проводять у спеціальних пристроях — електролізерах або електролітичних ваннах. При електролізі на катоді відбувається процес віднов-лення, а на аноді ― процес окиснення.
При електролізі розплавів солей на катоді здійснюється процес відновлення катіонів металів:
 ,
,
а на аноді — окиснення кислотних залишків, наприклад:
 .
.
Електроліз водних розчинів проходить дещо складніше, оскільки в про-цесі можуть брати участь і молекули води.
Послідовність розрядки катіонів на катоді описується такими прави-лами:
1) при електролізі водних розчинів електролітів, що мають катіони металів, які розташовані в ряду стандартних електродних потенціалів від літію до алюмінію включно, на катоді відновлюються (розряджаються) тільки молекули води за схемою:
2H2O+2e®H2+  .
.
2) при електролізі водних розчинів електролітів, що мають катіони металів, які розташовані в ряду стандартних електродних потенціалів від марганцю до водню, на катоді можуть одночасно відновлюватися як молекули води, так і катіони металів за схемою:
2H2O+2e®H2+  ;
;
 .
.
3) при електролізі водних розчинів електролітів, що мають катіони металів, які розташовані в ряду стандартних електродних потенціалів після водню, на катоді відновлюються тільки катіони металів за схемою:
 .
.
При наявності в розчині кількох видів катіонів у першу чергу розряджа-ються катіони, які мають більш позитивний потенціал.
Хід катодного процесу при електролізі залежить тільки від електроліту. Хід анодних процесів залежить ще й від матеріалу аноду.
Аноди поділяють на інертні або нерозчинні (графіт, золото, платина) та активні або розчинні.
Інертні аноди не беруть участі в електрохімічних процесах і є хімічно стійкими щодо розчину електроліту та продуктів електролізу, які утворюються.
На інертних анодах, залежно від виду аніона, в розчині або розплаві можуть відбуватися такі процеси:
1. Якщо в розчині присутні аніони безкисневих кислот S2-,I-,Br-,Cl- (крім F-) або іони  , то відбувається окиснення цих аніонів у послідовності:
, то відбувається окиснення цих аніонів у послідовності:
 ,
,
тобто в першу чергу розряджаються ті іони, які мають менше значення по-тенціалу;
2. Якщо в розчині вказані аніони відсутні, то молекули води розряджаються за схемою:
2H2O-2e®O2+4H+.
З аніонами кисневмісних кислот, наприклад,  і т. ін., крім особливих випадків, ніяких перетворень не відбувається.
і т. ін., крім особливих випадків, ніяких перетворень не відбувається.
У випадку розчинних анодів відбувається розчинення металу, з якого виготовлений анод (якщо стандартний електродний потенціал цього металу менший за стандартний потенціал кисневого електрода, тобто 1,23 В):
 .
.
Розчинними анодами, які безпосередньо беруть участь в електролізі, можуть бути: мідь, нікель, цинк, срібло та ін. При цьому виді електролізу анод (метал) окиснюється (розчиняється), катіони металу, що утворюються, переміщуються до катода і відновлюються на ньому до металу. Таким чином, метал розчинного анода осідає на катоді.
Розглянемо кілька прикладів електролізу водних розчинів електролітів з нерозчинним і розчинним анодами.
Приклад 1. Електроліз водного розчину хлориду міді (II) з графітовими електродами:
 ;
;
 ;
;
 .
.
Приклад 2. Електроліз водного розчину сульфату нікелю (II) з інертним анодом:
 ;
;
 2H2O+2e®H2+2OH-;
2H2O+2e®H2+2OH-;
 .
.
Приклад 3. Електроліз водного розчину нітрату цинку з розчинним цинковим анодом:
 ;
;
 ;
;
 .
.
Кількісні характеристики електрохімічних процесів описуються зако-ном Фарадея: маса речовини, що виділяється на електродах під час електро-лізу, пропорційна кількості електрики,що проходить через розчин і не залежить від інших факторів. Маса речовини, яка виділяється при проходженні I Кл електрики, дорівнює молярній масі електрохімічного еквівалента.
Математичний вираз об’єднаного закону Фарадея:
 ,
,
де m — маса окисненої або відновленої речовини, г.
ME — молярна маса еквівалента речовини, г/моль,
I — сила струму, А;
t — час, с.;
F — стала Фарадея.
Електроліз знаходить широке застосування в багатьох галузях про-мисловості.
Розділ 6.
МЕТАЛИ
6.1. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
Із відомих 110 хімічних елементів 88 є металами. До елементів–металів належать s–елементи І і ІІ груп, усі d- і f-елементи, а також р-елементи голов-них підгруп: ІІІ(крім В), ІV(Ge,Sn,Pb), V(Sb,Bi) і VI(Pо) груп.
Атоми металів, як правило, мають у зовнішньому електронному шарі 1,2 і
значно рідше 3 або 4 електрони.
Метали визначаються здатністю їхніх атомів легко віддавати свої вален-тні електрони і перетворюватися на позитивні іони внаслідок низьких значень електронегативностей, які обумовлені невисокими енергіями іонізації атомів і невеликою (часто від’ємною) спорідненістю до електрона.
Метали як прості речовини. Елементи-метали утворюють прості речовини тієї ж назви. За звичайних умов це тверді речовини кристалічної будови (крім ртуті) з металічним типом зв’язку (див.р.4.3.). Кристалічні решітки металів складаються з нейтральних атомів і позитивних іонів, які оточені вільними електронами. Рух електронів відбувається хаотично, подібно до руху молекул газу (рис. 26).

 |
Хімічні властивості металів. Метали як відновники взаємодіють з окисниками, наприклад, з киснем, галогенами, сіркою, азотом, фосфором. Лужні та лужноземельні метали взаємодіють також з воднем:
t°
2Cu+O2 ® 2CuO;
t°
2Na+Cl2 ® 2NaCl;
t°
2Al+3S ® Al2S3;
3Mg+N2 ® Mg3N2;
3Ca+2P® Ca3P2;
2Na+H2 ®2NaH.

Активні метали взаємодіють з водою за кімнатної температури, метали середньої активності — при нагріванні, малоактивні метали (Cu, Ag, Au, Pt) з водою не взаємодіють
2Na+2H2O ® 2NaOH + H2
t°
Zn +H2O ® ZnO + H2.
Метали взаємодіють з кислотами з утворенням солей, але в залежності від активності металу, природи та концентрації кислоти продукти відновлення ки-слоти можуть бути різними:
Zn + 2HCl(розв.)®ZnCl2 + H2 ;
Cu+4HNO3(конц.)®Cu(NO3)2+2NO2+2H2O;
Cu+2H2SO4(конц.)®СuSO4+SO2+2H2O.
Деякі метали, що утворюють амфотерні гідроксиди, взаємодіють з лугами:
Zn+2NaOH+2H2O®Na2[Zn(OH)4]+H2.
Метали взаємодіють з розчинами солей менш активних металів:
Zn+CuSO4® ZnSO4 + Cu.
Активні метали (Mg, Al, Na) взаємодіють з оксидами металів:
t°
Fe2O3 + 2Al ® Al2O3.
Алюміній широко використовують у промисловості для добування бага-тьох металів з їхніх оксидів (алюмінотермія).
Сплави. У розплавлених металах можуть розчинятися інші метали, складні речовини та неметали. Під час охолодження таких розчинів утворюються сплави. Сплави, як і метали, у твердому стані мають кристалічну будову. Під час кристалізації деяких сплавів утворюються хімічні сполуки. Кристали інших сплавів складаються з атомів вихідних металів, які хімічно не зв’язані один з одним (тверді розчини).
У світі для потреб техніки виробляється 75 металів і близько 1500 різних сплавів. Наприклад, чавун — це залізовуглецевий сплав, у якому масова частка вуглецю понад 2.14%. Сталь — залізовуглецевий сплав з масовою часткою вуглецю меншою за 2.14%. Дюралюміній містить 95% Al, 4%Cu, 0.5%Mg і 0.5%Mn.
Властивості сплавів відрізняються від властивостей компонентів сплаву. Температура плавлення сплаву, як правило, нижча за температуру плавлення найбільш легкоплавкого його компонента, а твердість вища, ніж твердість скла-дових частин сплаву. Особливо сильно зростає твердість сплаву, якщо під час сплавлення утворюються хімічні сполуки металів. Високою твердістю характе-ризуються сплави, що містять тверді розчини. Низькі температури плавлення, висока твердість надають сплавам більшої цінності для сучасної техніки, ніж цінність металів, з яких їх виготовляють.
Поширення у природі й одержання металів. У земних умовах більшість металів є стійкими в окисненому вигляді. У вільному стані в земній корі трапляються лише метали, які в ряду стандартних електродних потенціалів знаходяться праворуч від водню — Cu, Hg, Ag, Au, Pt. Переважно в природі метали існують у вигляді сполук — оксидів, сульфідів, сульфатів, хлоридів, карбонатів, фосфатів і нітратів.
Усі промислові способи одержання металів засновані на окисно–віднов-них реакціях. У процесі добування металів їх переводять з хімічних сполук у нейтральні атоми. Наприклад, пірометалургійні способи полягають у віднов-ленні оксидів за високих температур за допомогою вуглецю, оксиду вугле-цю(II), алюмінію, кремнію або водню
ZnO+C®Zn+CO.
Гідрометалургійні способи засновані на реакціях переведення сполук металів у розчин і відновлення з них металів за допомогою електролізу або інших металів (цими способами одержують золото, срібло, цинк тощо).
Далі ми більш детально розглянемо властивості сполук магнію та кальцію, тому що вони широко застосовуються у будівництві.
6.2. Магній, кальцій та їхні сполуки
Магній Mg та кальцій Са належать до головної підгрупи ІІ групи еле-ментів періодичної системи. У зовнішньому електронному шарі атомів еле-ментів цієї підгрупи розміщується по два валентних s-електрона, отже, ці елементи є металами.
Поширення в природі. Вміст у земній корі Mg — 2,4, Ca — 2,96 %. У вільному стані ці метали не трапляються. Найважливішими з магнієвих та кальцієвих мінералів є: магнезит MgCO3, доломіт MgCO3·СаCO3, азбест, Mg3Ca(SiO3)4 вапняк, мармур, крейда, склад яких відповідає одній формулі СаCO3, гіпс CaSO4×2H2O, ангідрит CaSO4.
Оксиди та гідроксиди Mg та Са. Оксиди цих металів у промисловості і в лабораторії добувають термічним розкладанням відповідних карбонатів або гідроксидів.
Наприклад, під час нагрівання магнезиту утворюється оксид магнію (па-лена магнезія)
t
MgCO3® MgO+CO2.
MgO має температуру плавлення 2800°С. Сильно прожарений MgO дуже твердий, не розчиняється у воді та кислотах, його використовують для виго-товлення різних вогнетривких виробів і штучних будівельних матеріалів— ксилоліту та фіброліту, а також для одержання магнезіального в’яжучого (магнезіального цементу), який утворюється згідно з рівнянням:
MgO+MgCl2+H2O®2MgOHCl.
Магнезіальний цемент—в’яжучий матеріал, використовується для виго-товлення точильних каменів, млинових жорен.
Оксид кальцію одержують розкладанням вапняку CaCO3 за температури 900°С:
t
CaCO3 ® CaO+CO2.
СаО відомий під назвою негашене, або палене, вапно. Після гашення во-дою утворюється гашене вапно:
СаО + Н2О ® Са(ОН)2.
Воно застосовується у будівництві та у виробництві соди. Суміш гашеного вапна, піску та води називається будівельним розчином.
Солі магнію та кальцію. З солей магнію та кальцію найбільше застосовують карбонати і сульфати кальцію.
Карбонат кальцію СаСО3, наприклад, мармур —цінний будівельний мате-ріал. Великі кількості вапняку та крейди застосовують у цементній та скляній промисловостях. Термічним розкладанням вапняку добувають негашене вапно та вуглекислий газ. Магнезит MgCO3 використовують для добування оксиду магнію.
Термічним розкладанням сульфату кальцію у вигляді мінералу гіпсу CaSO4×2H2O одержують будівельний гіпс (алебастр)
t
CaSO4×2H2O ®CaSO4×0,5H2O+1,5H2O.
Під час змішування з водою алебастр знову перетворюється на тверду масу — двоводний гіпс CaSO4×2H2O. Про інші різновиди гіпсу мова піде в розділі 8.
6.3. ТВЕРДІСТЬ ВОДИ ТА МЕТОДИ ЇЇ УСУНЕННЯ
Твердість води зумовлюють катіони Са2+, Mg2+ та катіони деяких важких металів. Оскільки в природних водах переважають іони Са2+ і Mg2+, а інші присутні не завжди і в незначних кількостях, то загальна твердість природних вод може бути охарактеризована сумою концентрацій іонів Са2+ та Mg2+ (ммоль е/л). Один ммоль е відповідає вмісту у воді 20,04 мг/л іонів Са2+ або 12,156 мг/л іонів Mg2+.
Твердість природних вод змінюється в широких межах. За величиною за-гальної твердості природні води поділяються на групи: вода дуже м’яка (менше ніж 1,5 ммоль е/л), вода м’яка (від 1,5 до 3,0 ммоль е/л), вода середньої твердості (від 3,0 до 5,4 ммоль е/л), вода тверда (від 5,4 до 10,7 ммоль е/л), вода дуже тверда (понад 10,7 ммоль е/л).
Найбільш м’якими є води атмосферних осадів, твердість яких становить 0,07-0,1 ммольекв/л. Найбільша твердість спостерігається в водах світового океану, для яких середнє значення твердості дорівнює 130,5 ммольекв/л. Припустима твердість води для господарчо-питного водопостачання становить не більше, ніж 7ммольекв/л.
Загальна твердість поділяється на карбонатну і некарбонатну. Перша з них зумовлена присутністю гідрокарбонатів та карбонатів кальцію і магнію (Ca(HCO3)2, Mg(HCO3)2, CaCO3, MgCO3). Оскільки карбонати кальцію та маг-нію важкорозчинні речовини, то часто під карбонатною твердістю розуміють гідрокарбонатну твердість, зумовлену добре розчинними гідрокарбонатами Ca(HCO3)2, Mg(HCO3)2. Ці солі при нагріванні розкладаються з виділенням оксиду вуглецю (IV) і осаду карбонатів. Таким чином, при кип’ятінні твердість води, спричинена гідрокарбонатами кальцію та магнію, усувається. Тому така твердість називається усувною або тимчасовою.
Сульфати, хлориди, а також кальцієві та магнієві солі інших кислот характеризують некарбонатну або постійну твердість води. Солі, що зумовлю-ють твердість води, не шкідливі для живих організмів, однак наявність їх у великих кількостях небажана, оскільки вода стає непридатною для господарчо-побутових потреб. Тверда вода не дає піни з милом, оскільки розчинні натрієві солі жирних кислот, що входять до складу мила, переходять у нерозчинні кальцієві солі цих кислот.
У твердій воді погано розварюються овочі, крупи, м’ясо, скорочується термін служби тканин, утворюються осади у водопровідних трубах та ін. Тверду воду неможна використовувати у деяких технологічних процесах, наприклад, при фарбуванні. Вода, що містить солі твердості, цілком непридатна для постачання парових котлів через утворення накипу, що призводить до перегріву котла і сприяє його швидкому руйнуванню. Вода з підвищеною тимчасовою твердістю непридатна для охолодження тепло- обмінної апаратури, оскільки при нагріванні гідрокарбонати кальцію та магнію розкладаються до карбонатів, які осідають на стінках теплообмінника.
Наведені приклади вказують на необхідність видалення з води, що вико-ристовується з технічною метою, солей кальцію та магнію. Цей спосіб водопід-готовки називають водопом’якшенням.
Зниження концентрації іонів Са2+ і Mg2+ можна досягти термічними, реа-гентними та іоно-обмінним методами.
При кип’ятінні води усувається переважно тимчасова твердість через ви-ділення осадів CaCO3 та MgCO3:
t°
Ca(HCO3)2 ® CaCO3¯+CO2+H2O;
t°
Mg(HCO3)2®MgCO3¯+CO2+H2O.
Крім того, частково усувається також сульфатна твердість, оскільки роз-чинність CaSO4 зменьшується при підвищенні температури.
Такі ж термічні методи як виморожування та дистиляція дозволяють поз-бутися не тільки солей твердості а і взагалі знесолити воду.
Реагентні методи пом’якшення води засновані на переведенні іонів Са2+ і Mg2+ у важкорозчинні сполуки (карбонати, фосфати та інші): З цією метою вико-ристовують вапно, соду, фосфати, поліфосфати та ін.:
Ca(OH)2 + Ca(HCO3)2 ® 2CaCO3¯+ 2H2O
Na2CO3 + CaCl2 ® CaCO3 ¯ + 2NaCl
2Na3PO4 + 3Ca(HCO3)2 ® Ca3(PO4)2¯ + 6NaHCO3.
Іоно-обмінний метод пом’якшення води полягає в обміні іонів Са2+, Mg2+ та інших металів, що знаходяться у воді, на іони Н+ або Na+, що входять до складу іоногенних груп катіонітів
 |
2H2O + 2CO2
2HR + Ca(HCO3)2 <=> CaR2 + 2H2CO3
2NaR +CaSO4 <=> CaR2 + Na2SO4.
Оскільки іонний обмін — оборотний процес, то відновити обмінні влас-тивості катіоніту можна, пропускаючи розчини NaCl або HCl через шар катіо-ніту, який насичений іонами Са2+, Mg2+ або інших металів.
Якщо природну воду пропустити не тільки через Н-катіоніт, а ще й через ОН--аніоніт, то можна позбутися всіх катіонів металів і аніонів, розчинених у воді, тобто повністю знесолити воду.
Розділ 7.
Дата публикования: 2015-09-18; Прочитано: 2414 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
