 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Термодинамические процессы поршневых двигателей внутреннего сгорания
|
|
Прежде чем перейти к рассмотрению рабочих процессов в поршневых двигателях приведем некоторые сведения из физики и термодинамики.
Закон Бойля-Мариотта: “При постоянной температуре удельные объемы газа обратно- пропорциональны давлениям”, т.е
 , (7)
, (7)
где ν – удельный объем газа, т.е. объем одного килограмма газа ( ); здесь V объем газа в м3 и G – масса этого объема в кг; p1 и p 2 – давления, МПа.
); здесь V объем газа в м3 и G – масса этого объема в кг; p1 и p 2 – давления, МПа.
Закон Гей- Люссака: “При постоянном давлении, при изменении температуры газа на 10С его объем соответственно изменяется на 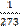 часть первоначального объема” или
часть первоначального объема” или
 ,
,
 .
.
После деления первого уравнeния на второе получим
 , (8)
, (8)
где Т =273+ t 0 – абсолютная температура.
Между удельным объемом и плотностью имеется зависимость
ρν =1 или ρ =  , (9)
, (9)
где ρ – масса одного кубического метра газа, кг/м3.
Подставляя в уравнение (8) в место v величину ρ, получим
 . (10)
. (10)
Итак, удельные объемы газов прямо пропорциональны их температурам, а объемные веса обратно пропорциональны им.
Уравнение Клапейрона-Менделеева: “При изменении давлений и температур газа его удельные объемы изменяются прямо пропорционально температурам и обратно пропорционально давлениям”, т.е.
 (11)
(11)
или
 , (12)
, (12)
где R – газовая постоянная, характерезующая данный газ (R =  , где m – молекулярная масса), Дж/(моль
, где m – молекулярная масса), Дж/(моль 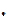 град).
град).
Последнее уравнение можно предсавить в следуюшем виде
 , Н∙м/кг. (13)
, Н∙м/кг. (13)
Это выражение носит название характеристического уравнения газов.
В том случае, когда имеется не 1 кг газа, а G кг, тогда его объем V 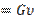 и характеристическое уравнение принимает вид
и характеристическое уравнение принимает вид
PV=GRT, Hм. (14)
Закон Авогадро: “При одинаковых температурах и давлениях равные объемы содержат одинаковoе количество молекул различных газов”. По этому молекулярные массы m 1 и m 2 двух газов пропорциональны их плотностьям ρ 1 и ρ 2 и обратно пропорциональны удельным объемам  и
и  , т.е.
, т.е.
 , (15)
, (15)
отсюда
 (16)
(16)
т.е. объемы одной моли всех газов при одинаковой температуре и одинаковом давлении одинаковы. Килограмм-моль – число килограммов вещества, численно равное молекулярной массе (m).
Произведение удельного объема газа на его молекулярную массу (mν) носит название объема моли.
Объем одной моли, например кислорода (m =32 кг/моль), при объемной массе ρ =1,31 кг/м3 (при давлении 0,1 МПа и температуре 150С) составляет

Объем одной моли для всех газов является величиной постоянной и равной 24,4 м3/моль.
Масса одной моли Gмоли численно равна молекулярному весу

Число молей М газа равняется его весу G, деленному на ее массу m кг одной моли, т.е.
М = 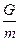 . (17)
. (17)
Удельный объем ν газа равен объему одной моли, деленному на ее массу m кг, т.е.
 , м3/кг. (18)
, м3/кг. (18)
На основании последних формул можно характеристическое уравнение представить в следующем виде
R =  .
.
При давлении р =0,1 МПа, температуре 150С (Т=2730+150) и V моли =24,4 м3/моль газовая постоянная R будет
 , [Н×м/(кг×град)]. (19)
, [Н×м/(кг×град)]. (19)
Следовательно, величина 8485 представляет собой работу в Н  м расширения при постоянном давлении одной моли любого газа при нагревании его на 10. Размерность величины 8485 Н
м расширения при постоянном давлении одной моли любого газа при нагревании его на 10. Размерность величины 8485 Н  м/ (моль
м/ (моль  градус).
градус).
Теперь характеристическое уравнение газа можно представить так
PV=GRT =  ,
,  . (20)
. (20)
Дата публикования: 2015-09-17; Прочитано: 507 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
