 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Спирти
|
|
Спирти — органічні речовини, молекули яких містять гідроксильні групи —ОН, сполучені з вуглеводневими радикалами. Загальна назва спиртів — гідроксильні сполуки.
Залежно від числа гідроксильних груп, що містяться в молекулі, розрізняють одноатомні, двохатомні, трьохатомні спирти:
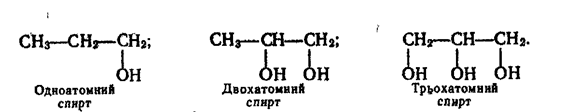
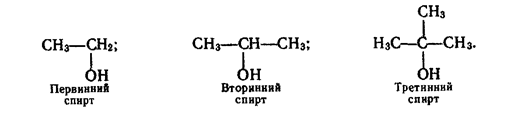
Спирти поділяють також на первинні, в яких гідроксильна група сполучена з первинним вуглецевим атомом, вторинні — група —ОН приєднана до вторинного атома вуглецю і третинні — група —ОН знаходиться біля третинного вуглецю. Приклади таких спиртів:
Номенклатура та ізомерія гідроксильних сполук
Номенклатура. За міжнародною номенклатурою назви спиртів утворюють від назв відповідних алканів з додаванням закінчення -ол. Після закінчення зазначають номер вуглецевого атома, біля якого знаходиться гідроксильна група. Нумерацію вуглецевих атомів починають з того кінця ланцюга, до якого ближче розташована гідроксильна група. У назви двохатомних та інших багатоатомних спиртів перед закінченням -ол. додають префікс ди- (ді-), три- і т. д. залежно від кількості груп, а потім зазначають положення всіх груп. Приклади:
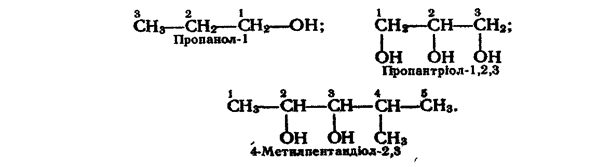
Для деяких спиртів поширені назви за раціональною номенклатурою. Ці назви утворюють з назви радикала і слова «спирт», наприклад: СН 3 ОН — метиловий спирт, С2Н5ОН - етиловий спирт, (СН3)2СНОН - ізопропіловий спирт.
Ізомерія. Ізомерія спиртів пов'язана як з розгалуженням вуглецевого ланцюга, так і з різним положенням гідроксильної групи. Наприклад, бутанол С4Н9ОН може мати такі ізомери:

Наведені ізомери різняться властивостями, наприклад температурами кипіння, які дорівнюють 117,3°С (бута-нол-1); 99,5°С (бутанол-2); 108,4°С (2-метилпропа-нол-1); 82,5°С (2-метилпропанол-2).
Насичені одноатомні спирти
До насичених одноатомних спиртів належать аліфатичні спирти, молекули яких містять одну гідроксильну групу, сполучену з алкільним радикалом.
Гомологічний ряд. Члени гомологічного ряду насичених одноатомних спиртів мають загальну формулу СnН2n+1ОН, де n = 1, 2, 3, 4. Першими членами цього ряду є СН3ОН — метанол, С2Н5ОH — етанол, С3Н7ОН — пропанол, С4Н9ОН — бутанол.
Властивості. За звичайних умов насичені одноатомні спирти з нормальною будовою ланцюга, що містять від 1 до 11 атомів вуглецю,— це безбарвні рідини. Зі збільшенням молекулярної маси спиртів їх розчинність у воді зменшується: метанол, етанол і пропанол змішуються з водою в будь-яких співвідношеннях, бутаном та інші рідкі за звичайних умов спирти розчиняються у воді мало, а вищі спирти практично не розчиняються у воді.
Спирти мають досить високі температури кипіння. Це пов'язано з асоціацією їх молекул, яка відбувається так само, як і асоціація молекул води, за рахунок утворення водневих зв'язків між молекулами RОН (R — вуглеводневий радикал):

Хімічні властивості спиртів обумовлені переважно наявністю гідроксильної групи в молекулі.
1. Взаємодія з лужними металами. Під дією лужних металів на спирти утворюються алкоголяти:

Ця реакція відбувається з розривом зв'язку О—Н у гідроксильній групі.
2. Взаємодія з галогеноводнями та іншими галогеновмісними речовинами. Під дією ґалогеноводнів або хлоридів фосфору РСl5, РСІ3 на насичені одноатомні спирти відбувається заміщення групи ОН у спиртах на галоген, наприклад:

Ця реакція за участю гідроксильної групи відбувається з розривом зв'язку С—О.
3. Дегідратація. При наявності фосфорної або концентрованої сірчаної кислоти при нагріванні від спиртів відщеплюється вода і утворюються ненасичені вуглеводні, наприклад:

4. Взаємодія з кисневмісними кислотами. Спирти реагують з кислотами, утворюючи складні ефіри. Наприклад, під час взаємодії метанолу з азотною кислотою утворюється складний ефір азотної кислоти — метилнітрат:

Складні ефіри утворюються також при взаємодії спиртів з органічними кислотами.
5. Окислення. Під час спалювання спиртів (окислення киснем повітря) утворюються оксид вуглецю (IV) і вода:

При каталітичному окисленні киснем повітря, окисленні перманганатом калію, дихроматом калію при наявності сірчаної кислоти утворюються альдегіди і кетони, наприклад:

Третинні спирти більш стійкі до окислення. Тільки під дією сильних окислювачів вони можуть окислюватися з розщепленням вуглецевого ланцюга.
6. Дегідрування. Під час каталітичного дегідрування первинних спиртів утворюються альдегіди, вторинних спиртів — кетони:

Каталізатором дегідрування спиртів звичайно є мідь (температура 300°С).
Добування. Насичені спирти можна добути гідролізом галагенопохідних відповідних алканів водним розчином лугу, наприклад:

Бромбутан Бутанол
Спирти утворюються також при гідратації алкенів:

Спирти можна добути відновленням інших кисневмісних сполук — альдегідів і кетонів.
Інші методи добування спиртів розглянуто при вивченні окремих представників гомологічного ряду.
Метанол. Метанол, або метиловий спирт, СН3ОН — безбарвна рідина з характерним запахом спиртів. Дуже отруйний.
Найважливіший промисловий метод добування метанолу ґрунтується на використанні синтез-газу (суміш СО з Н2), який добувають конверсією метану з водяною парою. Для добування метанолу синтез-газ пропускають над каталізатором (сумішшю оксидів міді, цинку і алюмінію) при температурі 200-300°С і тиску 6—8 МПа:

Старий метод промислового добування метанолу полягає в сухій перегонці деревини, внаслідок чого спирт дістав назву деревного.
Метанол — важливий продукт хімічної промисловості. У великих кількостях його переробляють на формальдегід. З нього добувають і інші органічні речовини, наприклад ефіри кислот. Метанол використовують у промисловому органічному синтезі як метилуючий агент (для введення могильної групи в різні сполуки).
Метанол застосовують як розчинник у лакофарбовій промисловості, як компонент пального для автомобілів (добавка метанолу до бензину підвищує октанове число пального).
Етанол. Етанол, або етиловий спирт, С2Н5ОН — безбарвна рідина з характерним запахом. Тривіальна назва етанолу — винний спирт.
Основним промисловим методом добування етанолу є каталітична гідратація етилену. Реакція відбувається над каталізатором на основі фосфорної кислоти при температурі 260—300°С і тиску 7—8 МПа:

Етанол утворюється під час бродіння продуктів, що містять крохмаль і цукристі речовини (зерна, фруктів, овочів). Бродіння—складний процес. Сумарну реакцію, яка відбувається під час бродіння поширеної цукристої речовини — глюкози С6Н12O6, можна виразити рівнянням:

Недоліком цього методу добування спирту є використання харчової сировини.
Як сировину для добування етанолу можна використати деревину, що містить целюлозу. Під час гідролізу целюлози утворюється глюкоза, зброджуванням якої добувають етанол.
Етанол є одним з великотоннажних продуктів промислового органічного синтезу. Він застосовується у виробництві оцтової кислоти, бутадієну-1,3, ефірів. Як розчинник етанол застосовують у лакофарбовій промисловості. У великих кількостях його використовують у виробництві ліків і в харчовій промисловості. З технічною метою часто застосовують денатурований спирт — етанол з домішкою речовин, шкідливих для організму.
Насичені багатоатомні спирти
Багатоатомні спирти містять у молекулі кілька гідроксильних груп.
Двохатомні спирти називають д і о л а м и, або гліколями. Назви двохатомних спиртів за міжнародною номенклатурою складають з назви відповідного алкану з додаванням закінчення -діол і цифр, які означають положення гідроксильної групи в ланцюгу.
Трьохатомні спирти називають тріодами, або гліцеринами. їх назви будують аналогічно до назв двохатомних спиртів, але з додаванням закінчення -тріол.
Найпростіші представники двох- і трьохатомних спиртів:

Властивості. Хімічні властивості багатоатомних спиртів багато в чому подібні до властивостей одноатомних спиртів. При цьому в реакціях може брати участь як одна, так і дві і більше гідроксильних груп. Нижче розглядаються властивості багатоатомних спиртів на прикладі етиленгліколю і гліцерину. Це безбарвні в'язкі сиропоподібні рідини, солодкуваті на смак, добре розчиняються у воді.
1. Взаємодія з лужними металами. Лужні метали витісняють водень з гідроксильних груп з утворенням гліколятів або гліцератів:
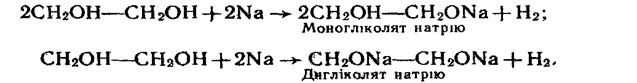
Аналогічно реагує з лужними металами гліцерин, при цьому можуть утворюватись моно-, ди- і тригліцераги.
2. Взаємодія з галогеноводнями. Багатоатомні спирти реагують з галогеноводнями (НС1, НВг, НІ) з утворенням гадогенозаміщених спиртів або галагенопохідних алканів:

3. Взаємодія з кислотами. З кислотами багатоатомні спирти утворюють складні ефіри, наприклад:

Складні ефіри гліцерину з органічними кислотами називають жирами.
4. Взаємодія з гідроксидом міді (II). Ця реакція характерна тільки для багатоатомних спиртів. Осад гідроксиду міді (II) розчиняється в етиленгліколі та гліцерині з утворенням розчину яскраво-синього кольору:


У записаних формулах гліколяту і гліцерату міді (II) стрілками показані донорно-акцепторні зв'язки (мідь — акцептор). Сполуки такого типу належать до комплексних.
Добування і застосування етиленгліколю і гліцерину. Етиленгліколь добувають у промисловості гідратацією (приєднання води) етиленоксиду:

Як і одноатомні спирти, етиленгліколь можна добути гідролізом галагенопохідних алканів водним розчином лугів. Для цієї реакції необхідні 1,2-дигалогенопохідні етану:

Етиленгліколь утворюється під час пропускання етилену крізь розчин перманганату калію, при цьому відбуваються окислення і гідратація етилену:
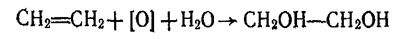
Гліцерин добувають синтетичне з пропілену за такою схемою:

Гліцерин входить до складу природних сполук — жирів рослинного і тваринного походження — і може бути виділений з них.
Етиленгліколь і гліцерин використовуються в промисловому органічному, синтезі.
Гліцерин застосовують для виробництва мастил, як пом'якшувач шкіри і тканин, у парфумерній, фармацевтичній і харчовій промисловості.
Водні розчини етиленгліколю і гліцерину замерзають при низьких температурах, тому їх використовують як антифризи — рідини з низькою температурою замерзання, які застосовуються для охолодження двигунів внутрішнього згоряння.
Гліцерин.
Єдиний практично важливий представник трьохатомного спирту. Сіропоподібна солодка рідина, без кольору, добре розчинна у воді. Водні розчини гліцерину замерзають при низькій температурі.
Гліцерин широко розташований у природі, є основним спиртом, приймає участь у будові молекул різних груп ліпідів. У промисловості гліцерин добувають гідролізом ацилгліцеринів:
О
½½
 СН2-О-С-R
СН2-О-С-R
О СН2ОН
½½ ½
 СН-О-С-R1 + 3Н2О ® СН-ОН + R-СООН + R1-СООН + R2-СООН
СН-О-С-R1 + 3Н2О ® СН-ОН + R-СООН + R1-СООН + R2-СООН
О ½ карбонові кислоти
½½ СН2ОН
СН2-О-С-R2 гліцерин
тригліцерин
Гліцерин широко використовується в багатьох галузях промисловості. Основна його кількість витрачається для добування похідних - гліфталевих смол, нітрогліцерину.
У харчовій промисловості гліцерин використовують для приготування лікерів та безалкогольних напоїв, у паперовій та шкіровеній - для збереження матеріалів від висихання. Він входить у склад багатьох косметичних препаратів і широко використовується як пом'ягчуюча шкіру речовина.
Лекція № 7
Тема: Карбонільні речовини. Альдегіди.
Мета: Вивчити властивості альдегідів, їх добування та застосування. Навчитися складати формули ізомерів альдегідів та називати їх по номенклатурі ІЮПАК.
План:
1. Будова, номенклатура, ізомерія альдегідів.
2. Властивості і добування альдегідів.
Карбонільні сполуки містять у молекулі карбонільну групу 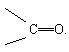 . Карбонільні сполуки поділяютьнаальдегіди і кетони.
. Карбонільні сполуки поділяютьнаальдегіди і кетони.
Альдегіди. Номенклатура, властивості і добування
У молекулах альдегідів карбонільна група сполучена з вуглеводневим радикалом і атомом водню (або з двома атомами водню), тобто загальна формула цих сполук

Номенклатура. Назви альдегідів за замісниковою номенклатурою згідно з правилами IUРАК будують з назви відповідного вуглеводню з додаванням закінчення -аль. Перед коренем назви записують бічні замісники, зазначаючи їх положення і кількість. Нумерацію атомів вуглецю починають з вуглецевого атома карбонільної групи. Приклади:

Для альдегідів широко використовують тривіальні назви, які аналогічні назвам відповідних органічних кислот. У табл. наведено назви за замісниковою номенклатурою та тривіальні назви деяких насичених альдегідів.

Властивості. Перший член гомологічного ряду насичених альдегідів НСНО — безбарвний газ, кілька наступних альдегідів — рідини. Вищі альдегіди — тверді речовини.
У карбонільній групі зв'язок між атомами кисню і вуглецю сильно полярний: електронна густина зміщена в бік атома кисню  . Для карбонільних сполук характерні реакції нуклеофільного приєднання. В цих реакціях нуклеофільні агенти (негативно заряджені частинки) приєднуються до атома вуглецю карбонільної групи, а електрофільні агенти (позитивно заряджені частинки) приєднуються до атома кисню.
. Для карбонільних сполук характерні реакції нуклеофільного приєднання. В цих реакціях нуклеофільні агенти (негативно заряджені частинки) приєднуються до атома вуглецю карбонільної групи, а електрофільні агенти (позитивно заряджені частинки) приєднуються до атома кисню.
Вплив атома кисню в карбонільних сполуках передається по ланцюгу. Наприклад, у сполуці, що має фрагмент 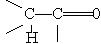 , внаслідок зміщення електронної густини до кисню атом водню, сполучений з другим вуглецевим атомом, виявлятиме підвищену рухливість — його легко відірвати або замістити.
, внаслідок зміщення електронної густини до кисню атом водню, сполучений з другим вуглецевим атомом, виявлятиме підвищену рухливість — його легко відірвати або замістити.
Отже, карбонільна група обумовлює високу реакційну здатність альдегідів.
1. Реакції приєднання. Альдегіди легко приєднують ціановодень НСN і гідросульфіт натрію NaНSО3:
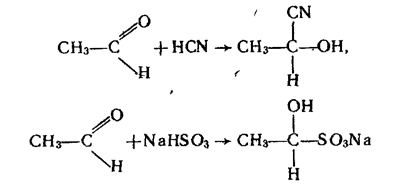
Продукти приєднання NаНSO3 — кристалічні речовини, розчинні у воді. При нагріванні з кислотами вони розпадаються з утворенням вихідного альдегіду. Тому останню реакцію використовують для очистки альдегідів.
При наявності нікелевих або платинових каталізаторів альдегіди приєднують водень і відновлюються до первинних спиртів, наприклад:

Приєднуючи спирти, альдегіди утворюють сполуки, що мають назву а ц е т а л і в. Реакція відбувається при наявності кислот:

Ацеталі — це прості ефіри двохатомного спирту. Вони легко гідролізуються з утворенням вихідних речовин.
2. Реакції полімеризації і конденсації. Ці реакції характерні для альдегідів і обумовлені реакційною здатністю карбонільної групи. Процеси полімеризації розглядаються далі, при вивченні властивостей формальдегіду і ацетальдегіду.
Дві молекули альдегіду можуть сполучатися одна з одною при наявності лугу з утворенням сполуки з довшим вуглецевим ланцюгом, яка містить альдегідну і гідроксильну групи:

Таку речовину називають альдолем. При відщепленні молекули води від гідроксибутаналю утворюється альдегід, що містить подвійний зв'язок у ланцюгу:

Подібні реакції конденсації альдегідів називаються реакціями альдольно-кротонової конденсації. При конденсації інших альдегідів реакція також завжди відбувається з участю другого вуглецевого атому однієї з молекул, наприклад:

3. Окислення. Під час окислення альдегідів, яке відбувається дуже легко, утворюються органічні кислоти або їхні солі. Наприклад, під час окислення оцтового альдегіду утворюється оцтова кислота:

Н
Якісною реакцією на альдегіди є реакція срібного дзеркала — окислення їх аміачним розчином оксиду срібла при нагріванні:

Металічне срібло, яке виділяється, вкриває стінки посудини тонким блискучим шаром.
Альдегіди окислюються також гідроксидом міді (II), який відновлюється до червоно-коричневого оксиду міді (І):

4. Заміщення кисню карбонільної групи. Атом кисню в молекулі альдегіду може бути заміщений на галоген під дією галогенідів фосфору РС15 або РВr5, наприклад:

Під дією гідроксиламіну NH2ОНна альдегіди карбонільний кисень заміщується на оксімідну групу = N - ОН:

Азотовмісна органічна сполука, що утворюється, належить до о к с и м і в.
5. Взаємодія з галогенами. Як уже зазначалось, атом водню біля другого вуглецевого атома вуглеводневого ланцюга альдегідів має підвищену рухливість. Під час взаємодії альдегідів з хлором чи бромом цей водневий атом легко заміщується на галоген, наприклад:
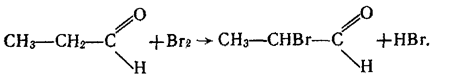
Добування. 1. Альдегіди утворюються під час окислення або каталітичного дегідрування (відщеплення водню) первинних спиртів:
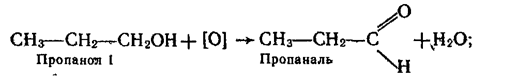

Каталітичне дегідрування спирту відбувається при наявності металічної міді.
2. Альдегіди можна добути гідролізом дигалогенопохідних алканів, наприклад:

3. Альдегіди утворюються під час взаємодії алкенів з оксидом вуглецю (II) і воднем (оксосинтез):

Оксосинтез відбувається при наявності каталізаторів — комплексних сполук кобальту під тиском 5-10 МПа.
Лекція № 8
Тема: Карбонові кислоти.
Мета: Вивчити класифікацію карбонових кислот, їх властивості, добування, застосування. Навчитися складати структурні формули ізомерів кислот, та називати їх по замістковій номенклатурі.
План:
1. Номенклатура та ізомерія насичених одноосновних кислот.
2. Властивості і добування насичених одноосновних кислот.
Карбоновим кислотами називаються органічні речовини, до складу яких входять карбоксильна група -COOH. Карбоксильна група складається із сполучених карбонільної і гідроксильної груп, що визначило її назву.
У карбоновим кислотах карбоксильна група сполучена з вуглеводневим радикалом R, тому в загальному вигляді формулу карбонової кислоти можна записати так: R—COOH.
У карбонових кислотах карбоксильна група може сполучатися з різними вуглеводневими радикалами — насиченими, ненасиченими, ароматичними. У зв'язку з цим виділяють насичені, ненасичені та ароматичні карбонові кислоти, наприклад:

Насичена кислота Ненасичена кислота Ароматична кислота
Залежно від числа карбоксильних груп, що містяться в молекулах карбонових кислот, розрізняють одноосновні та двохосновні кислоти, наприклад:

Одноосновна кислота Двохосновні кислоти
Одноосновні кислоти називають також монокарбоновими, а двохосновні — дикарбоновими кислотами.
Гомологічний ряд насичених одноосновних кислот
Загальна формула членів гомологічного ряду насичених одноосновних карбонових кислот СnН2n+1СООН, де n = 0, 1, 2, 3....
Номенклатура. Назви карбонових кислот за замісниковою номенклатурою будують з назви відповідного алкану з додаванням закінчення -ова і слова «кислота».
Якщо вуглецевий ланцюг розгалужений, то на початку назви кислоти записують замісник, зазначаючи його положення в ланцюгу. Нумерацію атомів вуглецю в ланцюгу починають з вуглецю карбоксильної групи. Приклади:
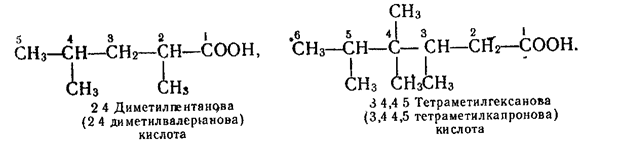
Для деяких членів гомологічного ряду насичених карбонових кислот застосовують тривіальні назви. В табл. 26.1 наведено формули деяких насичених одноосновних кислот і їх назви за замісниковою номенклатурою та тривіальні назви.

Ізомери. Починаючи з бутанової кислоти С3Н7СООН, члени гомологічного ряду насичених одноосновних кислот мають ізомери, їх ізомерія зумовлена розгалуженістю вуглецевого ланцюга вуглеводневих радикалів. Так, Бутанова кислота має такі два-ізомери (у дужках дано тривіальну назву):

Властивості і добування насичених одноосновних кислот
Властивості. Кислоти гомологічного ряду з нормальною будовою від мурашиної до С8Н17СООН за звичайних умов - безбарвні рідини, що мають різкий запах. Вищі члени ряду, починаючи з С9Н19СООН,- тверді речовини. Мурашина, оцтова і пропіонова кислоти добре розчиняються з нею в будь-яких співвідношеннях. Інші рідкі кислоти обмежено розчиняються у воді. Тверді кислоти у воді практично нерозчинні.
Особливості хімічних властивостей карбонових кислот зумовлені сильними взаємним впливом карбонільної С=О і гідроксильної О-Н-груп.
У карбоксильній групі зв¢язок між вуглецем й карбонільним киснем сильно полярний. Проте позитивний заряд на атомі вуглецю частково зменшується в наслідок притягання електронів атома кисню гідроксильної групи. Тому в карбонових кислотах карбонільний вуглець менш схильний до взаємодії з нуклеофільними частинками, ніж в альдегідах і кетонах. З іншого боку, під впливом карбонільної групи підсилюється полярність зв¢язку О-Н за рахунок зміщення електронної густини від кисню до атома вуглецю. Всі зазначені особливості карбоксильної групи можна проілюструвати такою схемою:

Розглянутий характер електронної будови карбоксильної групи зумовлює відносну легкість відщеплення атома водню цієї групи. Тому у карбонових кислот добре виявленні кислотні властивості. У безводному стані і особливо у водних розчинах карбонові кислоти дисоціюють на іони:
СН3 - СН2 - СООН Û СН3 - СН2 - СОО- + Н+.
Кислотний характер розчинів карбонових кислот можна встановити за допомогою індикаторів. Карбонові кислоти є слабкими електролітами, при чому сила карбонових кислот зменшується зі збільшенням молекулярної маси кислоти.
Для насичених одноосновних кислот найбільш характерні реакції, зумовлені кислотними властивостями, а також реакції заміщення гідроксильної групи.
1. Взаємодія з металами. Карбонові кислоти реагують з деякими металами з утворенням солей і водню, наприклад:
2CH3COOH + Mg ® Mg(CH3COO)2 + H2
Ацетат магнію
2. Взаємодія з основними оксидами і основами. Як усі кислоти, карбоксильні сполуки реагують з основними оксидами і основами, наприклад:
2С2Н5СООН + MgO ® Mg(С2Н5СОО)2 + H2O;
С2Н5СООН + KOH ® С2Н5СООK + H2O
з водним розчином аміаку, який виявляє властивості основ, карбонові кислоти також утворюють солі:
С2Н5СООН + NH3 ® С2Н5СООNН4.
3. Взаємодія зі спиртами. Карбонові кислоти реагують зі спиртами при наявності сильних неорганічних кислот. Від молекули кислоти відщеплюється група ОН, від молекули спирту — атом Н, в результаті утворюються складні ефіри:

4. Взаємодія з галогенідами фосфору і сірки. Галогеніди фосфору (РСІ 5, РСІ3) і сірки (SОСl2) взаємодіють з карбоновими кислотами, утворюючи хлорангідриди кислот, наприклад:
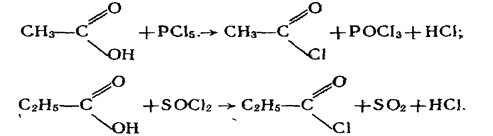
5. Взаємодія з водовідбирними агентами. Під дією сильних водовідбирних речовин, наприклад Р2O5, на карбонові кислоти утворюються ангідриди кислот:
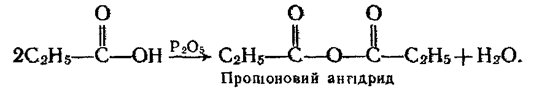
6. Взаємодія з галогенами. Яків альдегідах, хлор і бром можуть заміщувати атом водню біля другого вуглецевого атома з утворенням галогеноза заміщених кислот, наприклад:

7. Відновлення і каталітичне гідрування. Відновлюючи карбонові кислоти, можна добути альдегіди і первинні спирти, наприклад:

Відновлення кислот відбувається дуже важко.
Добування. Основні метода добування карбонових кислот такі.
1. Окислення первинних спиртів і альдегідів. Спирти і альдегіди окислюються досить легко наприклад:

Під час окислення кетонів, вторинних і третинних спиртів у жорстких умовах (сильні окислювачі, нагрівання) відбувається розщеплення вуглецевого ланцюга молекул і утворюється, як правило, суміш карбонових кислот. Наприклад, окислюючи ацетон, можна добути суміш мурашиної і оцтової кислот.
2. Окислення алканів. Суміш нижчих алканів (бутан—октан) окислюється при наявності каталізаторів переважно до оцтової кислоти. Алкани, що містять 9—20 вуглецевих атомів, окислюються до вищих кислот.
3. Гідроліз нітрилів. Нітрили—сполуки типу R— С=N. Під час нагрівання нітрилів з додою, в яку добавлено неорганічні кислоти, утворюються карбонові кислоти, наприклад:

4. Карбонілування алкенів. Кислоти, починаючи з пропіонової, можна добути приєднанням оксиду вуглецю (II) і води до алкенів. Каталізатором реакції є фосфорна кислота, процес відбувається при температурі 300—350°С і тиску 20—30 МПа. Приклад:

Лекція № 9
Тема: Оксикислоти.
Мета: Вивчити структурні формули, класифікацію оксикислот.
План:
1. Класифікація оксикислот.
2. Властивості оксикислот.
Дата публикования: 2015-09-18; Прочитано: 6125 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
