 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Законы идеального газа
|
|
В молекулярно-кинетической теории используется модель идеального газа, в которой считают:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Реальные газы при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу.
Рассмотрим эмпирические законы, описывающие поведение идеальных газов.
1. Закон Бойля – Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
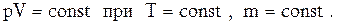
Процесс, протекающий при постоянной температуре, называется изотермическим. Кривая, изображающая зависимость между величинами  , характеризующими свойства вещества при постоянной температуре, называется изотермой. Изотермы представляют собой гиперболы, расположенные тем выше, чем выше температура, при которой происходит процесс (рис. 1).
, характеризующими свойства вещества при постоянной температуре, называется изотермой. Изотермы представляют собой гиперболы, расположенные тем выше, чем выше температура, при которой происходит процесс (рис. 1).

2. Закон Гей-Люссака: объем данной массы газа при постоянном давлении изменяется с температурой линейно:
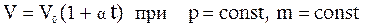 . (1)
. (1)
Здесь  - температура по шкале Цельсия,
- температура по шкале Цельсия, 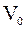 - объем газа при 0 0С,
- объем газа при 0 0С,
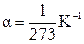 - температурный коэффициент объемного расширения газа.
- температурный коэффициент объемного расширения газа.
Процесс, протекающий при постоянном давлении и неизменной массе газа, называется изобарным. В ходе изобарного процесса для газа данной массы отношение объема к термодинамической температуре постоянно:
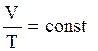 .
.
На диаграмме в координатах 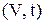 этот процесс изображается прямой, называемой изобарой (рис. 2).
этот процесс изображается прямой, называемой изобарой (рис. 2).
3. Закон Шарля: давление данной массы газа при постоянном объеме изменяется линейно с температурой:
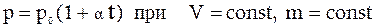 . (2)
. (2)
Здесь 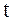 - температура по шкале Цельсия,
- температура по шкале Цельсия, 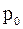 - давление газа при 0 0С,
- давление газа при 0 0С, 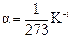 - температурный коэффициент давления газа.
- температурный коэффициент давления газа.
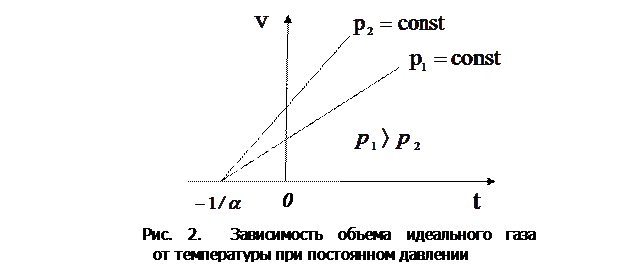

Процесс, протекающий при постоянном объеме и неизменной массе газа, называется изохорным. В ходе изохорного процесса для газа данной массы отношение давления к термодинамической температуре постоянно:
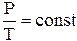 .
.
На диаграмме в координатах  этот процесс изображается прямой, называемой изохорой (рис. 3).
этот процесс изображается прямой, называемой изохорой (рис. 3).
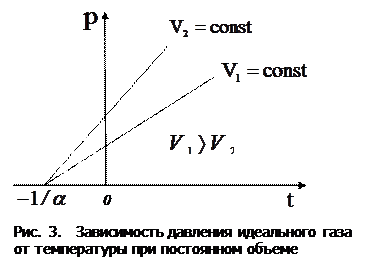
Вводя в формулах (1) и (2) термодинамическую температуру T, законам Гей-Люссака и Шарля можно придать более удобный вид: 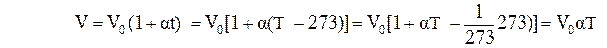 ,
,
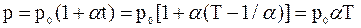 .
.
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы.
Так, при нормальных условиях один моль любого газа занимает объем 22,4 м-3. При одинаковых температуре и давлении любой газ содержит в единице объема одинаковое количество молекул.
При нормальных условиях в 1 м3 любого газа содержится число частиц, называемое числом Лошмидта:
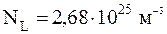 .
.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений 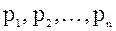 входящих в нее газов:
входящих в нее газов:
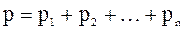 .
.
Парциальное давление – давление, которое создавал бы газ, входящий в состав газовой смеси, если бы он занимал объем, равный объему смеси при той же температуре.
Дата публикования: 2015-09-17; Прочитано: 458 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
