 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Масса и размеры молекул. Количество вещества
|
|
Массы атомов и молекул малы и составляют величины порядка
10-26 кг (так, масса молекулы воды составляет 3·10-26 кг). Поэтому для характеристики масс атомов и молекул применяются безразмерные величины, получившие название относительной атомной массы элемента и относительной молекулярной массы вещества.
Относительной атомной массой (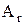 ) элемента называется отношение массы атома этого элемента к 1/12 массы атома 12С.
) элемента называется отношение массы атома этого элемента к 1/12 массы атома 12С.
Относительной молекулярной массой ( ) вещества называется отношение массы молекулы этого вещества к 1/12 массы атома 12С.
) вещества называется отношение массы молекулы этого вещества к 1/12 массы атома 12С.
Масса, равная 1/12 массы атома 12С, называется атомной единицей массы (а.е.м.). Обозначим ее 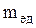 . Тогда масса атома будет равна
. Тогда масса атома будет равна 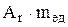 , а масса молекулы -
, а масса молекулы -  .
.
Макроскопическая система должна содержать число частиц сравнимое с числом Авогадро, чтобы ее можно было рассматривать в рамках статистической физики. числом Авогадро называется число атомов, содержащихся в 12 граммах углерода:
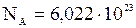
Отношение числа молекул N в макрообъекте к числу Авогадро  называют количеством вещества:
называют количеством вещества:
 .
.
В качестве единицы количества вещества используется моль, то есть количество вещества, которое содержит столько же частиц (атомов, молекул, ионов), сколько атомов содержится в 12 граммах углерода. Поэтому размерность числа Авогадро - моль-1.
Масса одного моля вещества называется молярной массой  . Молярная масса
. Молярная масса  связана с массой одной молекулы
связана с массой одной молекулы  соотношением:
соотношением:
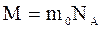
и измеряется в кг/моль.
Если 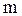 - масса всего вещества, то количество вещества
- масса всего вещества, то количество вещества 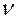 в молях равно:
в молях равно:
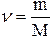 .
.
Объем одного моля газа (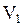 ) при нормальных условиях (давление
) при нормальных условиях (давление
 = 101,3 кПа; температура
= 101,3 кПа; температура  = 273 К) составляет 22,4·10-3 м3. Поэтому при нормальных условиях число молей газа, содержащихся в объеме
= 273 К) составляет 22,4·10-3 м3. Поэтому при нормальных условиях число молей газа, содержащихся в объеме  , можно записать и так:
, можно записать и так:
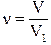 .
.
Дата публикования: 2015-09-17; Прочитано: 405 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
