 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Выделение металлов из растворов
|
|
Осаждение металловиз растворов с целью выделения основного металла или очистки растворов от примесей может осуществляться одним из следующих способов:
1. кристаллизация;
2. гидролиз;
3. осаждение сульфидов металлов;
4. цементация;
5. осаждение металлов восстановлением водородом;
6. экстракция;
7. ионообменная технология.
Кристаллизация
Кристаллизация - это процесс выделения из раствора твердой кристаллической фазы. Кристаллизация состоит из четырех стадий: достижения пересыщения раствора; образования зародышей кристаллов (центров кристаллизации); роста зародышей и превращения их в кристаллы определенной геометрической формы с развитыми гранями; перекристаллизации.
В гидрометаллургии цветных металлов кристаллизацию используют для выделения из растворов металлов в виде чистых солей, для разделения близких по свойствам элементов путем дробной кристаллизации солей с разной растворимостью, для очистки растворов от примесей и получения побочных продуктов гидрометаллургического производства.
Переход раствора в состояние пересыщения рассмотрим, используя рис.3, на котором представлена зависимость концентрации насыщенного раствора от температуры.


Температура
Рис.3. Зависимость концентрации насыщенного раствора от температуры:
1 - ненасыщенный раствор;
2 - насыщенный раствор: зона роста кристаллов;
3 - пересыщенный раствор: зона возникновения зародышей
Температура, при которой раствор находится в равновесии с выпавшими кристаллами, называется точкой кристаллизации. С понижением температуры растворимостьтвердых веществ в жидкостях уменьшается и раствор становится пересыщенным. Практически кристаллизацию никогда не проводят при температуре точки кристаллизации данного вещества, а при некотором переохлаждении.
Из начального состояния А можно перейти в состояние пересыщения С или Д, применяя два способа: 1) изменение концентрации раствора при удалении из него растворителя (воды) выпариванием при атмосферном или пониженном давлении и постоянной температуре до тех пор, пока раствор не сделается пересыщенным (А ® С); 2) понижение температуры раствора с целью снижения растворимости извлекаемого вещества и кристаллизации его при пересыщении раствора (А ® Д). В первом случае кристаллизацию называют изотермической, во втором, когда используют изменение растворимости соли при изменении температуры, - изогидрической.
При достижении пересыщения (точки С или Д) в растворе возникают центры кристаллизации (ЦК) и одновременно образуется достаточно большое количество зародышей, что обеспечивает в дальнейшем получение однородных по величине кристаллов. При самопроизвольном образовании зародышей новой фазы, способных к дальнейшему росту, кристаллизация является гомогенным процессом.
Образованию ЦК способствуют перемешивание, высокая концентрация и чистота раствора, а также небольшая молекулярная масса кристаллизующегося вещества. От количества возникающих ЦК зависят величина и форма выпавших кристаллов. При большом числе ЦК питание каждого из них растворенным веществом недостаточно, поэтому образуются мелкие кристаллы со слабо развитыми гранями, чаще всего пластинчатой или игольчатой формы.. При небольшом числе
ЦК кристаллы вырастают крупные и полногранные. Получению таких кристаллов способствует также внесение в раствор
уже готовых кристаллов выделяемого вещества, так называемой затравки. В этом случае говорят о гетерогенной кристаллизации. В реальном процессе кристаллизации гомогенное и гетерогенное образование зародышей может протекать параллельно и доля каждого зависит от условий кристаллизации.
Затем концентрацию раствора следует поддерживать ниже линии пересыщения (Ѯ и Д®Е). Тогда не будут образовываться новые зародыши, а будет происходить правильный рост всех кристаллов и получаться однородный продукт. Скорость кристаллизации увеличивается при перемешивании, увеличении поверхности твердой фазы (большое число ЦК), зависит от поверхностных и адсорбционных явлений.
При реализации способа А®С®В (выпариваниепри постоянной температуре) переход Ѯ достигается добавкой в маточныйраствор растворителя, в способе А®Д®Е (охлаждение раствора) переход Д®Е достигается за счет естественного снижения концентрации раствора по мере роста кристаллов и зародышей.
Завершающим этапом кристаллизации является перекристаллизация осадка, которая происходит благодаря динамическому равновесию между жидкой и твердой фазами в течение всего времени, когда осадок находится в контакте с раствором. В результате перекристаллизации изменяется гранулометрический состав осадка, кристаллы становятся более крупными и однородными, так как мелкие частицы растворяются, а крупные растут. Различают два вида перекристаллизации. Первая происходит за счет различной растворимости крупных и мелких частиц и ведет к укрупнению частиц. Вторая, структурная перекристаллизация, связана с несовершенством поверхности кристаллов, наличием в ней дефектов и ведет к совершенствованию структуры кристаллов.
На гидрометаллургических заводах кристаллизацию чаще всего осуществляют, сочетая выпариваниес последующим понижением температуры. Для этой цели применяют выпарные аппараты и кристаллизаторы (в том числе вакуумные).
Процесс кристаллизации сопровождается выделением тепла (теплота кристаллизации), затраченного ранее в качестве теплоты растворения. Чтобы предотвратить повышение температуры раствора за счет этого тепла, создают условия для свободного испарения раствора, на которое, как известно, требуется значительное количество тепла. На этом принципе работают кристаллизаторы с большой поверхностью испарения.
В вакуумных кристаллизаторах раствор испаряется и охлаждается до температуры, соответствующей давлению пара над раствором.
В цветной металлургии кристаллизация может иметь как самостоятельное значение (производство медного, никелевого, цинкового купоросов), так и сопутствовать другим гидрометаллургическим процессам. В последнем случае для получения пересыщенного раствора используют химическую реакцию, приводящую к образованию нового соединения, растворимостькоторого ниже концентрации в данном растворе. Этот способ широко используют при осаждении малорастворимых соединений (сульфидов, гидроксидов).
Так, в производстве глинозема операция декомпозиции сопровождается осаждением гидроксида алюминия. Для увеличения скорости кристаллизации Al(OH)3 алюминатные растворы предварительно разбавляют и охлаждают, а сам процесс декомпозиции проводят с воздушным перемешиванием и добавкой затравочного, ранее полученного гидроксида. Наличие даже незначительных количеств органических примесей в алюминатном растворе резко снижает скорость кристаллизации Al(OH)3.
Часто кристаллизация сопутствует электролизу. Например, при электролитическом рафинировании меди (никеля) наблюдается постепенное увеличение концентрации металла в электролите. Для сохранения постоянства концентрации меди (никеля) в растворе часть его отводят и выделяют медь (никель) в виде купоросов.
Дробнаякристаллизация. Ее используют для очистки солей от примесей и разделения близких по свойствам элементов.
Примеси резко снижают скорость кристаллизации. Кроме того, наличие примесей может привести к совместной кристаллизации их с основным веществом и получению загрязненных кристаллов. Поэтому для получения достаточно чистых кристаллов из промышленных растворов необходимо подбирать условия, при которых из большой группы веществ, содержащихся в растворе, кристаллизовалось бы только одно желательное, а остальные оставались бы в растворе, то есть следует проводить так называемую дробную кристаллизацию.
Она заключается в проведении ряда простых последовательных перекристаллизаций или осуществляется по схеме перекристаллизации с возвратом маточного раствора на предыдущие операции. Для достижения той же степени очистки от примесей во втором случае число ступеней кристаллизации приходится увеличивать, но при этом возрастает извлечениев очищенный продукт.
Дробная кристаллизация основана на разной растворимости веществ при различных температурах и зависит от двух свойств присутствующих в растворе твердых веществ: различной растворимости и способности кристаллизоваться в чистом виде.
В металлургии редких металлов метод дробной кристаллизации применяют для разделения таких близких по свойствам металлов, как тантали ниобийили цирконийи гафний. Так, при разделении тантала и ниобия используется различная растворимостькомплексных фторидов K2TaF7 и K2NbOF5 ž H2O в водном растворе HF. Ниобиевая соль имеет растворимость в 10-12 раз большую, чем танталовая, поэтому при определенной концентрации и температуре удается в одном конце цепи кристаллизаторов получить чистые кристаллы соли тантала, а на другом конце - чистый раствор соли ниобия.
Более сложную схему дробной кристаллизации солей применяют для разделения редкоземельных элементов на группы или на чистые соединения отдельных элементов.
Гидролиз
Взаимодействие ионов соли, находящейся в растворе, с ионами воды, в результате которого образуется малодиссоциированное вещество, выпадающее в осадок, носит название гидролитическогоосаждения ( или гидролиза). При гидролизе солей образуются, за счет связывания ионов воды (Н+ и ОН-), кислоты и основания и изменяется водородный показатель рН среды в ту или иную (щелочную или кислотную) сторону в зависимости от природы соли. В химическом смысле гидролизсолей обратен реакции нейтрализации. При гидролитическом выделении металлов они осаждаются в виде труднорастворимых соединений - гидроксидов или основных солей. Реакция образования гидроксида металла в ионном виде может быть выражена следующим уравнением:

 Me(OH)n(тв)
Me(OH)n(тв)
В этом случае произведение растворимости Me(OH)n равно:

где  и
и  - активности ионов Men+ и
- активности ионов Men+ и 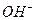 .
.
Гидролиз, как правило, является процессом обратимым и не протекает в обратном направлении, то есть в направлении растворения гидроксида, в том случае, когда  достаточно малая величина.
достаточно малая величина.
Гидроксиды металлов выделяются при определенном рН, значение которого является функцией  , активности
, активности  и заряда иона металла n в растворе:
и заряда иона металла n в растворе:
 ,
,
где KB - ионное произведение воды, равное 10-14.
Поскольку насыщенные растворы малорастворимых гидроксидов характеризуются малыми концентрациями ионов, приближенно можно считать, что

|
Из этого уравнения также следует, что с увеличением концентрации металла в растворе рН начала выделения гидроксида смещается в область более низких значений. Для данного металла с увеличением степени его окисления (заряда катиона n) рН выделения гидроксида также смещается в сторону более низких значений.
Осаждение металлов в форме гидроксидов используют для коллективного и селективного выделения их из растворов (например, при очистке цинковых и медных растворов от железа, сточных вод от ионов цветных металлов).
При наличии в растворе ионов нескольких металлов прежде всего начнет осаждаться гидроксид того металла, рН выделения гидроксида которого меньше (раствор кислее), а, следовательно, и растворимостьменьше. Таким образом, имеется возможность в каждом отдельном случае способствовать или препятствовать протеканию гидролиза путем прибавления к раствору некоторого количества кислоты или щелочи до определенной величины рН и производить фракционное осаждение гидроксидов примесей, присутствующих в промышленных растворах, так как каждая из них осаждается при различных значениях рН.
Гидроксиды Me3+ выделяются при более низких значениях рН, чем гидроксиды Me2+. Так, в промышленной практике используют способ отделения кобальта от никеля, основанный на окислении Со2+ до Со3+ ( = 2,0 ž 10-16,
= 2,0 ž 10-16,  = 6,4;
= 6,4;  = 3,0 ž 10-41,
= 3,0 ž 10-41,  = 1,0;
= 1,0;  = 1,0 ž 10-15,
= 1,0 ž 10-15, 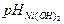 = 7,1). Окисляют Со2+ до Со3+ хлором, процесс проводят в слабокислой среде, добавляя воду для нейтрализации образующейся кислоты:
= 7,1). Окисляют Со2+ до Со3+ хлором, процесс проводят в слабокислой среде, добавляя воду для нейтрализации образующейся кислоты:
2CoSO4 + Cl2 + 3Na2CO3 + 3H2O =
= 2Co(OH)3 + 2NaCl + 2Na2SO4 + 3CO2
Гидроксид кобальта Со(ОН)3 осаждают при рН =1-2. Гидроксид никеля Ni(OH)2 в этих условиях не осаждается, хотя никельчастично соосаждается с кобальтом вследствие некоторого его окисления до Ni3+. Путем переосаждения получают Со(ОН)3 с содержанием примеси никеля 0,2-0,3 %.
При соблюдении определенных условий (тонком регулировании рН раствора) дробнымосаждением удается осуществить разделение очень близких по свойствам элементов, таких как лантаноиды.
В производстве глинозема гидролизиспользуется на операции декомпозиции - разложения алюминатного раствора с осаждением гидроксида алюминия:
NaAlO2 + 2H2O ® AL(OH)3 + NaOH
Гидратация - взаимодействие веществ с водой, при котором, в отличие от гидролиза и других реакций с участием воды, молекулы воды не разрушаются. Гидратация - частный случай сольватации, то есть взаимодействия растворенных частиц с молекулами растворителя.
При приготовлении известкового молока (гашении извести) происходит гидратацияоксидов кальция и магния по обратимым экзотермическим реакциям:
CaO + H2O  Ca(OH)2
Ca(OH)2
MgO + H2O  Mg(OH)2
Mg(OH)2
Направление реакций определяется температурой и парциальным давлением водяных паров, а скорость гидратации СаО и MgO - химическим и минералогическим составом и пористостью извести.
Осаждение сульфидов металлов
|
Равновесие в системе MeSтв  Me2+ + S2- определяется величиной произведения растворимости сульфида:
Me2+ + S2- определяется величиной произведения растворимости сульфида:
Lc = [Me2+] [S2-],
где [Me2+] и [S2-] - равновесные концентрации ионов Me2+ и S2-.
Трудорастворимые сульфиды металлов, подобно гидроксидам, выделяются при определенном значении рН раствора. При осаждении ионов двухвалентных металлов в форме сульфидов

где  - константа диссоциации сероводородной кислоты; [S2-] - общая концентрация ионов серы.
- константа диссоциации сероводородной кислоты; [S2-] - общая концентрация ионов серы.
Это уравнение позволяет оценить величину рН начала осаждения конкретного сульфида металла при известных значениях концентрации металла и серы в растворе или решить обратную задачу: определить остаточную концентрацию осаждаемого металла при заданном значении рН.
Согласно этому уравнению, величина рН сульфидообразования зависит от концентрации металла в растворе и концентрации осадителя: с увеличением концентрации ионов металла рН начала осаждения его сульфида смещается в более кислую область. Регулируя величину рН и количество добавляемого осадителя, можно селективно выделять сульфиды.
Для осаждения сульфидов чаще всего используют Na2S или (NH4)2S, реже CaS. Наиболее эффективным осадителем является сероводород Н2S, однако его использование предполагает ведение процесса в герметичных аппаратах. Если проводить процесс в автоклаве при повышенных давлении сероводорода и температуре, то интервал рН выделения сульфидов расширяется, а полнота и скорость их осаждения возрастают. В этом случае растворимостьсероводорода в водной среде зависит от его концентрации в газовой фазе в соответствии с равновесием



Осаждение сульфидов широко применяют в аналитической химии и как метод контроля чистоты растворов. Выделение сульфидов используют также в технологических процессах цветной металлургии. Так, из растворов, содержащих кобальти большие количества железа, выделяют при рН = 2-3 сульфидныйкобальтовый концентрат. В этих условиях растворимость СоS (10-24 моль/л) примерно в 25 раз ниже растворимости FeS (10-1 моль/л).
В производственной практике извлечения никеля и кобальта из железных руд никель-кобальтовый сульфидный концентрат осаждают из сернокислых растворов. Осаждение ведут из слабокислого раствора при 120-130 0С и  = 1 МПа. В осадок извлекают около 99 % никеля и 98 % кобальта.
= 1 МПа. В осадок извлекают около 99 % никеля и 98 % кобальта.
В молибденовом производстве для очистки растворов (NH4)2MoO4 от примесей меди и железа осаждают сульфиды этих металлов. В вольфрамовом производстве из растворов Na2WO4 cелективно выделяют молибденв виде МоS3 при рН = 3. Выделение сульфидов индия, таллия, рения используют в некоторых схемах производства этих металлов.
Различия в растворимости труднорастворимых соединений металлов (сульфидов, гидроксидов) и зависимость растворимости от рН и состава раствора позволяют проводить избирательное осаждение основного металла, оставляя сопутствующие металлы и примеси в растворе. Избирательное осаждение происходит до достижения определенного отношения активностей двух разных металлов в растворе. Затем неизбежно совместное осаждение соединений. При этом можно выделить следующие случаи: 1) совместное осаждение без образования твердых растворов - неизоморфное; 2) соосаждение вследствие образования твердых растворов - изоморфное.
Цементация
Для извлечения металлов из растворов в элементарной форме используют цементацию, осаждение газами-восстановителями при повышенных давлении и температуре (автоклавное осаждение) или электрохимическоеосаждение (электроэкстракцию).
Цементацией называется процесс вытеснения из раствора ионов одного металла Ме1 другим Ме2, более активным. При этом осаждающийся Ме1 переходит из ионного состояния в атомарное, а Ме2 - осадитель - из атомарного в ионное:
Me1n+ + Me20 ® Me10 + Me2m+
Цементацию широко используют в гидрометаллургии цветных и редких металлов преимущественно в следующих целях:
1) для очистки раствора, содержащего основной металл, от примесей, например, растворов сульфата цинка (цинкового электролита) от примесей меди и кадмия цементацией их на цинке:
CuSO4 + Zn = Cu(Zn) + ZnSO4
CdSO4 + Zn = Cd(Zn) + ZnSO4
При очистке растворов удаляют примеси менее активных металлов, чем основной компонентраствора. Во избежание загрязнения раствора ионами вытесняющего металла в качестве осадителя применяют металл, подлежащий в дальнейшем извлечению из электролита;
2) для выделения основного металла из раствора, например, извлечения меди цементацией на железе:
CuSO4 + Fe = Cu(Fe) + FeSO4,
золота - цементацией на цинке, индия - на цинке или алюминии и др.
Цементация - электрохимическийпроцесс, который часто называют внутренним электролизом. Этот процесс основан на электрохимической реакции между Me2- цементатором и ионом вытесняемого Me1.
При погружении металла-цементатора в раствор, содержащий ионы вытесняемого Me1, начинается электрохимическое взаимодействие, в результате которого на поверхности цементирующего Me2 образуются участки, покрытые вытесняемым Me1, - катодные участки. Одновременно возникают анодные участки, где протекает обратный процесс - ионизация атомов вытесняющего Me2 (рис.4).
Поскольку катодные и анодные участки соединены, электроны от анодных участков перетекают к катодным, где происходит разряд ионов вытесняемого Me1. Внешней цепью такого короткозамкнутого элемента служит электролит, омическое сопротивление которого зависит от концентрации ионов в растворе.

|
Рис.4. Схема процесса цементации
После образования катодных участков осаждение Me1 продолжается преимущественно на этих участках и в течение осаждения основной массы Me1 анодные и катодные участки разграничены. Осаждение Ме1 на уже образовавшихся катодных участках энергетически выгодней, так как не требует энергии на образование зародышей новой фазы.
Цементация состоит из двух последовательных стадий: 1) доставки ионов Ме1 к катодной поверхности (и отвода ионов Ме2 от анодной поверхности) через диффузионный и двойной слой; 2) электрохимического превращения, то есть разряда ионов на катодных участках и ионизации - на анодных участках. Контролирующая стадия процесса цементации зависит от величины и характера электродной поляризации.
Очевидно, что восстановление (разряд) катионов Ме1 на катодных участках поверхности и окисление (ионизация) цементирующего Ме2 на анодных участках протекают в процессе цементации сопряженно, так как должно сохраняться равенство числа электронов, поглощаемых при разряде катионов и отдаваемых при ионизации металла-цементатора. Иными словами, условием стационарности процесса цементации является равенство скоростей реакций, определяемых величиной анодного и катодного тока, при этом Jк = Jа.
Скорость цементации и лимитирующие процесс стадии могут изменяться во времени вследствие уменьшения концентрации вытесняемого Ме1 в растворе, увеличения толщины слоя осажденного Ме1, изменения поверхности катодных и анодных участков. В связи с этим весь процесс от начала до конца нельзя описать одним уравнением. В общем виде зависимость скорости цементации от времени характеризуется рис.5.


Время
Рис.5. Общий характер изменения скорости цементации во времени
В начальный (относительно короткий) период скорость возрастает со временем, что отвечает формированию катодных участков. Далее скорость процесса постепенно снижается по мере уменьшения концентрации ионов цементируемого Ме1 в растворе и роста слоя осадка.
Реакция цементации протекает достаточно быстро и полно в том случае, если разность в активностях металлов Ме1 и Ме2 достаточно велика. Активность металла определяется величиной его электродного потенциала Е, а возможность протекания цементации определяется соотношением величин 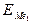 и
и  . Вытесняющий Ме2 должен обладать более отрицательным электродным потенциалом, чем вытесняемый Ме1:
. Вытесняющий Ме2 должен обладать более отрицательным электродным потенциалом, чем вытесняемый Ме1:
 <
< 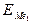
По мере выделения из раствора Ме1 изменяется активность(концентрация) его ионов и величина электродного потенциала  . Процесс цементации будет протекать до установления равновесия, когда
. Процесс цементации будет протекать до установления равновесия, когда  или в соответствии с уравнением Нернста:
или в соответствии с уравнением Нернста:

где  и
и  - стандартные электродные потенциалы Ме1 и Ме2.
- стандартные электродные потенциалы Ме1 и Ме2.
Из этого равенства следует выражение

позволяющее оценить отношение активностей (концентраций) ионов Ме1 и Ме2 в момент равновесия, то есть охарактеризовать предельную теоретическую глубину очистки раствора при цементации.
Цементация - это окислительно-восстановительный процесс. Положение того или иного металла в ряду напряжений характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение Е0, тем большими восстановительными способностями обладает металл в виде простого вещества и тем меньше окислительные способности проявляют его ионы и наоборот.
Пользуясь рядом напряжений, можно определить, какие металлы способны вытеснять (восстанавливать) данный металл из раствора его соли. Очевидно, это будут все металлы, более электроотрицательные, чем вытесняемый металл. Иными словами, любой Ме1 вытесняется (восстанавливается) металлом Ме2, стоящим левее в ряду напряжений.
Часто процессу цементации препятствуют кинетические затруднения. Например, железопрактически не цементируется на цинке при комнатной температуре, так как очень мала скорость процесса.
Существенное влияние может оказывать также связывание металлических ионов в прочные комплексы. Это приводит к сдвигу потенциала Ме1 в отрицательную сторону и малой скорости процесса (например, цементацияиндия на цинке).
Осаждение проводят обычно при определенном значении рН. Повышение кислотности приводит к излишнему расходу металла - цементатора вследствие реакции
2H+ + Me20 = Me22+ + H2
Низкая кислотность также невыгодна, так как происходит гидролизметалла-цементатора и выпадение его из раствора в осадок в виде гидроксида или основной соли.
С ростом температуры не во всех случаях улучшаются показатели цементации. Так, при увеличении температуры ускоряется цементациямеди на цинке, но замедляется осаждение кадмия.
Часто в конце процесса цементации, когда поверхность открытых анодных участков резко уменьшается, и при длительной выдержке осажденного металла в контакте с раствором наблюдается растворение осажденного металла. Менее подвержены окислению и растворению более грубозернистые осадки. Агрегации частиц осадка способствует присутствие в растворе поверхностно-активных веществ (например, клея).
Для успешного протекания процесса цементации необходимо соблюдение следующих условий:
1. цементирующий металл Ме2 должен образовывать растворимое соединение с анионом, который связан с замещаемым Ме1;
2. соединение, образующееся в результате цементации, не должно оказывать вредного действия на последующий передел;
3. цементирующий Ме2 должен находиться в избытке в твердой фазе, особенно если требуется удалить малые количества более электроположительного Ме1;
4. цементирующий металл Ме2 должен быть порошкообразным (Zn,Fe,Ni) или в виде стружки, обрези, листов (Zn,Al), так как чем больше его активная поверхность, тем быстрее и полнее идет процесс цементации;
5. раствор должен находиться в движении, что способствует диффузии ионов Ме1, а также удалению цементного осадка с поверхности металла - осадителя.
Цементацию на порошках металлов обычно проводят в каскаде аппаратов с мешалками. В последние годы получили распространение аппараты для цементации с кипящим слоем цементатора и пульсационные колонны.
В гидрометаллургии используют также цементацию металлов из растворов на амальгамах (амальгамы - сплавы металлов с ртутью). Большей частью для цементации применяют цинковую амальгаму, в некоторых случаях - натриевую. Цементацию на амальгаме цинка используют для извлечения из растворов таллия, индия, кадмия. Восстановление ионов самария и европия амальгамой натрия применяют для отделения этих элементов от других лантаноидов. Высокая плотностьртути делает возможным концентрирование больших количеств металла в небольшом объеме амальгамы. Металлы извлекают из амальгамы либо обработкой растворами кислот или щелочей, либо анодным растворением. Цементацию на амальгамах обычно проводят в реакторах с мешалками, в которых раствор контактирует с амальгамой.
По аналогии с амальгамами, для цементации галлия используют галламу алюминия (раствор алюминия в галлии, растворимостьалюминия в галлии при 30, 40 и 60 0С равна 0,62, 0,90 и 1,28% соответственно).
Несмотря на большое различие нормальных потенциалов галлия и алюминия в щелочных растворах (-1,22 и -2,35 В соответственно), цементациягаллия на алюминии неэкономична вследствие близости потенциала выделения водорода на алюминии (-1,36 В) к потенциалу выделения галлия. На галламах условия цементации галлия более благоприятны, чем на алюминии: потенциал алюминия в галламе ниже, чем потенциал чистого алюминия; перенапряжениеводорода на галламах больше (на галламе с концентрацией 0,3% А1 перенапряжение водорода равно -1,82 В). Оптимальные условия цементации: концентрация алюминия в галламе 0,5-1,0% (по массе), температура 40-45 0С, интенсивное перемешивание. В этих условиях из растворов, содержащих 0,11 г/л Ga, 50 г/л Al и 150 г/л NaOH, в течение 40 мин выделяется 99,2% галлия. Однако, высокие показатели достигаются лишь при условии очистки растворов от примесей кремния и ванадия. Очистка от этих примесей возможна путем добавления в раствор извести (СаО: А12О3» 1) и перемешивания раствора при температуре 85-90 0С. При этом в осадок выделяются ванадат, силикат, фосфат и арсенат кальция, а также 20-25% алюминия и около 10% галлия. Из очищенного раствора цементацией на галламе алюминия можно выделить 65-70% галлия или больше в зависимости от степени очистки раствора от примесей, в частности примесей органических веществ. В результате цементации получают технический галлий, который подлежит очистке.
Oсаждение металлов восстановлением водородом
В ионном виде реакция вытеснения металла из раствора водородом выглядит следующим образом:
Me2+ + H2  2H+ + Me0
2H+ + Me0
Константа равновесия этой реакции равна:

Таким образом, протекание процесса определяется следующими факторами: концентрациями в растворе водородных ионов Н+ и ионов вытесняемого металла Ме2+, давлением водорода  , а также температурой. Большое влияние на скорость осаждения металла водородом оказывает применение так называемых буферных добавок, то есть таких солей, которые поддерживают рН раствора на постоянном уровне, введение затравки, то есть кристаллов осаждаемого металла, увеличение температуры раствора и его перемешивание, способствующие растворению водорода.
, а также температурой. Большое влияние на скорость осаждения металла водородом оказывает применение так называемых буферных добавок, то есть таких солей, которые поддерживают рН раствора на постоянном уровне, введение затравки, то есть кристаллов осаждаемого металла, увеличение температуры раствора и его перемешивание, способствующие растворению водорода.
В промышленной практике это процесс реализуют как автоклавноеосаждение металлов, которое заключается в обработке концентрированных растворов металлов водородом при повышенных давлении и температуре. В автоклавной гидрометаллургии процессы восстановления водородом используют для осаждения меди, никеля, кобальта. Отличительными особенностями процесса являются большая скорость и получение металла в порошкообразном виде. Осаждение металлов из растворов с помощью водорода можно провести селективно, изменяя температуру раствора, давление водорода  и рН раствора. Электроположительные металлы (например, медь) могут быть выделены водородом в кислой среде; выделение электроотрицательных металлов возможно со значительной полнотой только из нейтральных и слабощелочных растворов.
и рН раствора. Электроположительные металлы (например, медь) могут быть выделены водородом в кислой среде; выделение электроотрицательных металлов возможно со значительной полнотой только из нейтральных и слабощелочных растворов.
Процесс вытеснения металлов из раствора водородом называют еще водороднойцементацией. Это означает, что реакция восстановления может протекать только в том случае, если потенциал водорода меньше, чем электродный потенциал металла;
 <
< 
В момент равновесия  и реакция осаждения прекращается. Стандартный потенциал водорода
и реакция осаждения прекращается. Стандартный потенциал водорода  . Уменьшить значение потенциала водорода можно повышением рН (уменьшением [ H+ ]) или увеличением давления водорода. Более эффективно изменение рН: так, изменение рН на единицу эквивалентно изменению
. Уменьшить значение потенциала водорода можно повышением рН (уменьшением [ H+ ]) или увеличением давления водорода. Более эффективно изменение рН: так, изменение рН на единицу эквивалентно изменению  в 100 раз. Вместе с тем необходимо поддерживать и определенное повышенное значение
в 100 раз. Вместе с тем необходимо поддерживать и определенное повышенное значение  для обеспечения более высокой концентрации водорода в водном растворе.
для обеспечения более высокой концентрации водорода в водном растворе.
Исследование зависимости потенциалов металлов от их концентрации в сульфатных растворах и потенциала водорода от рН и давления (рис.6) показало, что:

|
Рис.6. Зависимость потенциалов металлов от их концентрации в сульфатных растворах и потенциала водорода от рН и давления, МПа: 1 - 0,1; 2 - 10; 3 - 100.
- восстановление металла из раствора возможно во всех случаях, когда линия Еме = f ([Me2+]) лежит выше линии  = f (рН);
= f (рН);
- наиболее важным фактором, определяющим относительное положение Еме и  , является рН раствора;
, является рН раствора;
- с увеличением  понижается положение линии
понижается положение линии  , что несколько снижает предельные значения рН, при которых возможно выделение металлов;
, что несколько снижает предельные значения рН, при которых возможно выделение металлов;
- медь можно выделить при любых значениях рН, а другие металлы (Ni, Co, Cd, Fe) - в интервале рН = 4-10.
Механизм и кинетику восстановления металлов из водных растворов водородом рассмотрим на примерах осаждения меди, никеля и кобальта.
Осаждение меди. Медь можно выделить восстановлением водородом как из кислых, так и из щелочных растворов.
В кислых растворах ионы Cu2+ быстро реагируют с растворенным водородом, поэтому нет необходимости вводить катализатор (Ni,Co,Fe,Pd,Pt, коллоидный графит, оксиды меди, цинка, хрома) или затравку.
В сернокислом растворе восстановление меди описывается следующей результирующей реакцией:
CuSO4 + H2 ® Cu + H2SO4
Процесс проходит через следующие стадии:
Cu2+ + H2  CuH+ + H+ (1)
CuH+ + H+ (1)
CuH+ + Cu2+ ® 2Cu+ + H+ (2)
2Cu+ ® Cu + Cu2+ (3)
Согласно этой схеме медь выделяется в результате диспропорционирования ионов Cu+ по реакции (3), которая протекает быстро. Скорость процесса определяется стадиями (1) и (2).
Добавка буферной соли (Na2SO4), которая поддерживает рН раствора на постоянном уровне, сдвигает равновесие основной реакции в сторону восстановления. Для предотвращения поверхностных отложений порошка меди и регулирования его свойств вводят поверхностно-активные вещества (0,2-0,4 г/л). Процесс проводят при температуре 130-150 0С и давлении водорода 2,5-3,0 МПа.
При осаждении меди из аммиачных растворов при интенсивном перемешивании восстановление ионов Cu2+ протекает в две стадии:
Cu(NH3)42+ + Cu  2 Cu(NH3)2+
2 Cu(NH3)2+
Cu(NH3)2+ + 1/2 H2 ® Cu + NH3 + NH4+
Скорость второй реакции, определяющей скорость процесса в целом, не зависит от концентрации ионов Cu(NH3)2+ и пропорциональна общей поверхности осажденной меди и давлению водорода. Процесс проводят при температуре 200-210 0С и давлении водорода 1,5-2,0 МПа.
В обоих растворах содержание основного металла (меди) в порошке составляет 99,6-99,8 %.
Осаждение никеля и кобальта. Как уже указывалось, никельи кобальтможно полно осадить из растворов в интервале рН = 4-10. Однако практически это неосуществимо вследствие выделения при высоких значениях рН гидроксидов металлов. Это затруднение устраняется при осаждении никеля и кобальта из растворов, содержащих аммиачные комплексы. Вследствие медленности гомогенного зародышеобразования в раствор необходимо вводить затравку - порошок металлического никеля. Процесс имеет автокаталитический характер: выделяющийся металла ускоряет дальнейшее развитие реакции. Наиболее легко восстанавливаются комплексы Ni(NH3)22+ и Co(NH3)22+, так как максимальные скорости осаждения наблюдаются при отношении  = 2:1, чему соответствует и наибольшая разность потенциалов водорода и никеля.
= 2:1, чему соответствует и наибольшая разность потенциалов водорода и никеля.
Восстановление никеля и кобальта по реакциям:
Ni(NH3)2SO4 + H2 = Ni + (NH4)2SO4
Co(NH3)2SO4 + H2 = Co + (NH4)2SO4
протекает через ряд последовательных стадий:
1) растворение водорода в водном растворе (быстрая стадия);
2) транспорт водорода к поверхности (скорость зависит от интенсивности перемешивания);
3) активированная адсорбцияводорода на поверхности металла (быстрая стадия);
4) реакция восстановления сорбированных комплексных ионов металла водородом на поверхности (медленная стадия);
5) отвод продуктов реакции в объем раствора (быстрая стадия).
Процесс проводят при температуре 180-210 0С, давлении водорода 1,8-3,0 МПа и интенсивном перемешивании. Содержание основного металла (никеля и кобальта) находится в пределах 99,4-99,8 %.
Соединения некоторых металлов восстанавливаются водородом в водных растворах до малорастворимых низших оксидов. Так, ионы урана, ванадия и молибдена восстанавливаются по реакциям:
UO2(CO3)34- + H2 = UO2 + CO32- + 2HCO3-
2VO3- + 2H2 = V2O3 + 2OH- + H2O
MoO42- + H2 = MoO2 + 2OH-
Реакции протекают с достаточной скоростью в присутствии катализатора: порошка никеля (для первых двух реакций) или молибдена. Восстановление UO2(CO3)34 - проводят при  = 1,3 МПа и температуре 150 0С, МоО42 - при рН = 2, температуре 200 0С и
= 1,3 МПа и температуре 150 0С, МоО42 - при рН = 2, температуре 200 0С и  = 4-6 МПа. Выделение низших оксидов восстановлением водородом происходит полно даже из бедных растворов.
= 4-6 МПа. Выделение низших оксидов восстановлением водородом происходит полно даже из бедных растворов.
Кроме водорода, для восстановления из растворов некоторых металлов могут быть применены СО и SO2; монооксид углерода - для восстановления серебра, меди, никеля; диоксид серы - для восстановления меди. Сопоставляя данные по восстановлению меди из растворов SO2, H2 и СО, можно отметить, что наиболее эффективным восстановителем является водород, за ним следуют диоксид серы и монооксид углерода.
Экстракция
Для избирательного извлечения металлов из бедных растворов с последующим получением более богатых растворов, разделения близких по свойствам металлов, очистки растворов от примесей используют, в основном, экстракционные и ионообменные процессы. Эти процессы имеют много общего.
|
Одинаковыми являются и количественные характеристики равновесия в обоих процессах: коэффициенты распределения и разделения; степень экстракциив экстракционных процессах и полнота извлечения в ионообменных: в обоих случаях это отношение массы металла, перешедшего в экстрактили смолу, к общему количеству в исходном водном растворе, выраженное в долях или процентах.
Экстракция (или экстрагирование) - процесс извлечения вещества, в частности соединений металлов, из водного раствора в жидкую органическую фазу, не смешивающуюся с водой. Последующей реэкстракцией извлекают из органической фазы экстрагированный металл в водный раствор, из которого его и выделяют. При реэкстракции, применяя различные реэкстрагенты, можно разделять металлы, совместно экстрагированные в органическую фазу, то есть осуществлять избирательную реэкстракцию. Органическая фазавозвращается в цикл экстракции (рис.7).
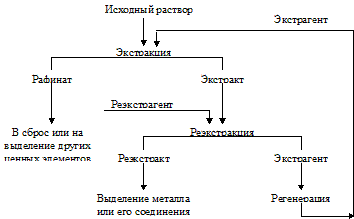
Рис.7. Принципиальная схема экстракционного извлечения металла из раствора
Приведем значения некоторых терминов. Экстрагент - органическое вещество, образующее с извлекаемым металлом соединение, способное растворяться в органической фазе. Экстрагентами служат органические кислоты, спирты, эфиры, кетоны, амины и др. Одним из наиболее часто применяемых в цветной металлургии экстрагентом является трибутилфосфат (ТБФ)- (C4H9O)3PO.
Разбавитель - органическое жидкое вещество, не смешивающееся с водой, служащее растворителем экстрагента. Применение разбавителей позволяет использовать твердые экстрагенты или уменьшить плотностьи вязкость жидких экстрагентов. Чаще всего в качестве разбавителей применяют керосин, а также ксилол, уайт-спирит и др.
Высаливатель - неорганическое вещество (обычно электролит), улучшающее показатели экстракции.
Экстракт и рафинат - соответственно органическая и водная фазы после экстракции.
Реэкстракт - водная фаза, полученная после реэкстракции, то есть извлечения металла из экстракта в водный раствор.
|
Экстракционный метод извлечения металлов имеет следующие преимущества: высокую селективность, позволяющую разделить близкие по свойствам элементы; легкость разделения двух жидких фаз; возможность извлечения металлов из сильно разбавленных растворов (проводятся опыты по извлечению золота и радиоактивных элементов из морской воды); возможность регенерации затраченных реагентов.
В экстракционном процессе участвуют не менее трех веществ (тройная система). Основной характеристикой экстракционных процессов является коэффициент распределенияD:
D = [A]C / [A]B,
где А - извлекаемый элемент, растворенный в виде соли в водной фазе В, то есть А и В - две полностью смешивающиеся жидкости (водный раствор), который требуется разделить экстракцией. Для этого в водный раствор (А в В) добавляют органический растворитель С, не смешивающийся с В и способный избирательно растворять А; [A]C и [A]B - концентрации элемента А в органической (С) и водной (В) фазах в условиях установившегося экстракционного равновесия (равновесные концентрации).
Таким образом, коэффициент распределения- это отношение равновесных концентраций элемента А в органической (экстракте) и водной (рафинате) фазах. Он показывает, насколько растворимостьэлемента А в органической фазе лучше, чем в водной. Чем больше D, тем выше способность данного экстрагента извлекать металл. Коэффициент распределения зависит от температуры, состава исходного раствора, типа и состава экстрагента.
С коэффициентом распределения непосредственно связаны две важнейшие технологические характеристики: извлечение (или степень экстракции) h, % - доля экстрагируемого элемента, перешедшего в органическую фазу, от общего его количества в обеих фазах; и коэффициент разделенияb, равный отношению коэффициентов распределения двух элементов:
b = D1 / D2,
где D1 и D2 - коэффициенты распределения разделяемых металлов.
Про величине b можно судить об эффективности применения экстракции для разделения данной пары элементов, то есть коэффициент разделенияхарактеризует селективность экстракции. По техническим требованиям величина b должна быть не менее 2.
Скорость установления равновесного распределения вещества между двумя контактирующими жидкими фазами - водной и органической - определяется: а) скоростью массопередачи веществ внутри водной и органической фаз и через границу их раздела; б) скоростью химических реакций в каждой из фаз или на межфазной границе.
В условиях интенсивного перемешивания фаз, осуществляемого в экстракторах, массопередача проходит с высокой скоростью. В экстракционных системах, используемых в гидрометаллургии, скорости химических реакций обычно также достаточно высокие. Поэтому большей частью равновесие устанавливается в течение 3-5 мин.
Приведем несколько примеров осуществления разных типов экстракции:
1. Экстракция ТБФ нитратов урана
UO2(NO3)2 + 2ТБФ = UO2(NO3)2 ž 2ТБФ
2. Экстракция аминами (Am) платиновых металлов:
2(AmH)Clорг + PtCl62- = (PtCl4 ž 2Am)орг + 2Н+ + 2Сl-
3. Экстракция индия ди-2-этилгексилфосфорной кислотой:
In3+ + 3(HR2PO4)2 = In(R2PO4)3 ž 3HR2PO4 + 3H+
Иногда проводят так называемую обменную экстракцию. Так, для очистки кобальтового раствора от примесей, например меди, раствор обрабатывают “кобальтовым мылом” (солью жирной кислоты СоR2, где R - кислотный остаток жирной кислоты СnH2n+1COO-):
(CuCl2)водн + (CoR2)орг = (СoCl2)водн + (CuR2)орг
В органическую фазу переходит тот металл, соль жирной кислоты которого менее растворима в воде. Ряд, в который располагаются металлы в зависимости от их способности переходить в органическую фазу, совпадает с рядом возрастания рН осаждения их гидроксидов: H+, Sn2+, Bi3+, Fe3+, Pb2+, Al3+, Cu2+, Cd2+, Zn2+, Ni2+, Co2+, Mn2+, Mg2+. Каждый левее стоящий металл, содержащийся в водном растворе в виде соли минеральной кислоты, вытесняет все правее стоящие металлы из органической фазы, в которой они содержатся в виде мыл.
В промышленности экстракцию проводят в форме многократных периодических (когда значения D велики) или непрерывных противоточных процессов (при малых значениях D). Последние осуществляют в аппаратах трех типов: в колоннах с насадкой или тарельчатых колоннах с пульсацией; в экстракторах типа смеситель-отстойник; в центробежных экстракторах.
Экстракцию металлов проводят также из растворов, получаемых непосредственно после операции выщелачивания. Схема “выщелачивание-экстракция-извлечениеметалла” эффективна для переработки низкосортного или полиметаллического сырья. В качестве примера рассмотрим экстракционное извлечение меди из растворов выщелачивания медной руды.
Основным способом извлечения меди из бедных растворов, получаемых при выщелачивании забалансовых руд, является цементация. К недостаткам цементационного способа извлечения меди относятся: накопление в оборотных растворах железа, осложняющего операцию выщелачивания, потребность в дефицитном высококачественном железосодержащем осадителе, необходимость дополнительной переработки цементационной меди.
Экстракция меди из бедных растворов обеспечивает высокую селективность, получение растворов, пригодных для электрохимического осаждения катодной меди, устойчивый водный баланс по всей схеме.
Извлечение меди из сульфатных растворов осуществляется экстрагентом, представляющим смесь реагента на основе оксиоксимов и керосина. Рафинат возвращают в цикл выщелачивания, а органическую фазу, насыщенную медью, подвергают реэкстракции (отработанным электролитом после осаждения меди). При реэкстракции медь из органической фазы переходит в водную, более богатую медью фазу (реэкстракт), которую направляют на электролиз, а регенерированный экстрагентвозвращают в цикл экстракции.
Новый тип химически активных веществ, получивших название “твердые экстрагенты” (ТВЭКС), представляет собой гранулированный сополимер стирола и дивинилбензола, микропоры которого заполнены жидким экстрагентом, удерживаемым в полимерной матрице капиллярными силами. По сравнению с ионообменными смолами, ТВЭКС характеризуются более высокой скоростью установления равновесного распределения экстрагируемых из водного раствора веществ. Вместе с тем они обладают преимуществами по сравнению со свободными жидкими экстрагентами, так как при их применении исключается эмульгирование и унос органической фазы. Кроме того, возможно использование ТВЭКС, подобно ионообменным смолам, для извлечения металлов из пульп. Исследования показали перспективность использования ТВЭКС для извлечения ряда редких металлов (U,Zr,Hf,Th,Ce,La), извлечения и разделения вольфрама и молибдена.
Ионообменная технология
Ионообменные процессы основаны на способности некоторых твердых веществ, называемых ионитами, при контакте с растворами электролитов поглощать ионы в обмен на ионы того же знака, входящие в состав ионита.
Иониты представляют собой трехмерные полимерные или кристаллические сетки, несущие ионогенные группы. Диссоциация ионогенной группы ионита дает ионную пару, один ион которой прочно (ковалентно) связан с сеткой ионита, а другой, противоположный по знаку или противоион, подвижен и может обмениваться на ионы одноименного заряда, поступающие из “внешнего” раствора. Благодаря эквивалентности обмена ионами обе фазы (раствор электролита и ионит) сохраняют электронейтральность в течение всего процесса. Иногда для простоты изображения взаимодействия раствора с ионитом трехмерную сетку вместе с фиксированными ионами называют каркасом (матрицей) и представляют ионит состоящим из каркаса и противоионов.
По знаку заряда обменивающихся ионов (противоионов) иониты делят на катиониты и аниониты. Существуют также амфотерные иониты - амфолиты, способные одновременно осуществлять и катионный и анионный обмен. Если обозначить каркас с фиксированными ионами R, то реакция катионного обмена может быть выражена уравнением:
2RH + Ca2+  R2Ca + 2H+,
R2Ca + 2H+,
а реакция анионного обмена
2RCl + SO42-  R2SO4 + 2Cl-
R2SO4 + 2Cl-
Ионный обмен имеет некоторое сходство с адсорбцией. Отличие состоит в том, что ионный обменпредставляет собой стехиометрическое замещение (на каждый эквивалент поглощенных ионов ионитотдает в раствор эквивалент ионов того же знака), тогда как адсорбциясостоит лишь в поглощении растворенного вещества.
В технике уже давно (преимущественно для очистки воды) нашли применение минеральные (природные) иониты - различные алюмосиликаты группы цеолитов, монтмориллонит (глинистый минерал), а также железоалюмосиликаты - глаукониты. Используют также синтетические неорганические иониты - пермутиты и силикагели. Емкость минеральных и синтетических неорганических ионитов сравнительно мала, кроме того, они разлагаются кислотами и щелочами, что ограничивает их применение.
Широкое применение ионитов в гидрометаллургии, химической технологии и других областях началось после создания (в 1936 г.) ионообменных синтетических смол, представляющих собой искусственные высокомолекулярные органические соединения. Выпускаемые в настоящее время ионообменные смолы, обладающие высокой емкостью, химической стойкостью и механической прочностью, вытеснили другие ионообменные материалы.
Ионообменные смолы применяют для решения следующих задач:
1) селективного извлечения металла из бедного раствора и получения более концентрированного раствора извлекаемого металла (например, извлечениеурана из растворов выщелачивания урановой руды, золота из растворов выщелачивания золотосодержащих руд, ряда цветных и редких металлов из сбросных растворов металлургических производств);
2) разделения близких по свойствам элементов: РЗЭ, Zr и Hf и др.;
3) получения высокочистой и умягченной воды;
4) очистки от примесей различных производственных растворов и обезвреживания сточных вод.
Синтетические ионообменные смолы имеют строение, сходное с пластмассами, однако введением ионогенных групп смолам придана электрохимическая активность. Как было указано, ионообменные смолы имеют каркас, состоящий из высокополимерной пространственной сетки углеводородных цепей, в которых закреплены фиксированные ионы: у катионитов - SO3-, COO-, PO32-, AsO32- и др., у анионитов - NH3+, NH2+, NH+, N+. Фиксированный ион связан с противоионом и образует с ним ионогенную группу, которую часто называют активной или функциональной группой. Активными группами являются SO3H, SO3 Na, COOH, PO3H2, AsO3Na2, NH3Cl и др.
От степени диссоциации активных групп зависит способность смолы к ионному обмену. Так, активная группа SO3H полностью диссоциирована (на SO3 - и Н+). Напротив, группа СООН даже в слабокислых растворах мало диссоциирована. Соответственно этому различают сильнокислотные катиониты (активные группы SO3H или PO3H2) и слабокислотные катиониты (активные группы СООН). Аналогично этому различают сильноосновные и слабоосновные аниониты. Слабокислотные катиониты работают лишь в нейтральных и щелочных средах, слабоосновные аниониты - в нейтральных и кислых. Ионогенные диссоциированные группы сильнокислотных катионитов и сильноосновных анионитов способны вступать в ионный обменпри любых значениях рН.
Особую группу смол составляют электроноионообменники (ЭИ). Они обладают, наряду с ионообменными, окислительно-восстановительными свойствами. Различают две группы ЭИ: с восстановительными и окислительными свойствами. В состав восстановительных ЭИ в качестве восстановителя вводят тонкодиспергированные металлы, например медь, или гидроксиды металлов низшей степени окисления, например Fe(OH)2. В состав окислительных ЭИ в качестве окислителя вводят гидроксиды высшей степени окисления, например Сu(OH)2, Fe(OH)3.
Физико-химические свойства ионитов. Определение свойств ионитов необходимо для выбора решения конкретной технологической задачи и аппаратурного оформления процесса. К основным свойствам ионитов относятся следующие: гранулометрический состав (размер гранул), термостойкость и механические свойства (прочность при истирании), плотность(удельный объем), набухание, обменнаяемкость, содержание некоторых ионов (F-, Cl-, OH-, CO32-). Важнейшими характеристиками ионообменных смол являются набухание и ряд обменных емкостей.
Дата публикования: 2015-07-22; Прочитано: 9801 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
