 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Качественная зависимость вязкости газов и жидкостей от температуры
|
|
В идеальном газе вязкость  не зависит от плотности (давления), а определяется величинами средней скорости и длиной свободного пробега молекул. Так как средняя скорость возрастает с повышением температуры
не зависит от плотности (давления), а определяется величинами средней скорости и длиной свободного пробега молекул. Так как средняя скорость возрастает с повышением температуры 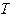 (несколько возрастает также и длина свободного пробега), то вязкость газов увеличивается при нагревании (пропорционально корню квадратному от температуры) (рисунок 9). Присутствие неуглеводородных компонентов в газе повышает вязкость природного газа.
(несколько возрастает также и длина свободного пробега), то вязкость газов увеличивается при нагревании (пропорционально корню квадратному от температуры) (рисунок 9). Присутствие неуглеводородных компонентов в газе повышает вязкость природного газа.
В жидкостях энергия активации уменьшается сростом температуры и понижением давления. В этом состоит одна из причин резкого снижения вязкости жидкостей с повышением температуры и роста её при высоких давлениях.
В силу того, что при больших давлениях газы приобретают свойства жидкости, то при давлениях больших 10 – 15 МПа вязкость природных газов падает с ростом температуры (рисунок 9), но само значение вязкости повышается с ростом давления.
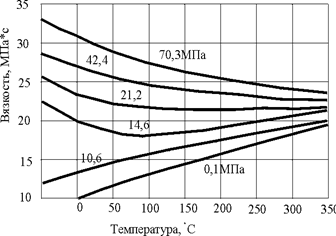
Рис. 9. Вязкость природного газа при различных значениях давлениях и температуры
3.4.3. Теплоёмкость
Теплоемкостью С называют количество теплоты, необходимое для нагревания единицы массы или объема вещества на 1 °С.
Удельная теплоемкость - отношение теплоёмкости к единице количества газа.
Для газов обычно различают теплоемкости при постоянном объеме С v и постоянном давлении Cp. С v связана с процессом, характеризующимся тем, что при неизменности объема вся энергия, сообщаемая газу в форме теплоты, затрачивается на увеличение внутренней энергии газа. Cp связана с процессом, характеризующимся тем, что, нагревая тело, предоставляют ему возможность расширяться при неизменном давлении. Таким образом, часть сообщенной телу теплоты идет на производство работы расширения. Поэтому 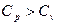 .
.
Для идеальных газов между Cp и С v существует следующее соотношение:
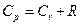 , где
, где 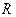 — газовая постоянная.
— газовая постоянная.
В области давлений, где газы считаются идеальными, значения теплоемкостей постоянны. Однако для реальных газов значения теплоемкости изменяются в зависимости от давления и температуры.
Для смеси газов теплоемкость определяется по сумме теплоемкости входящих компонентов по формуле:
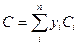 , (3.28)
, (3.28)
где Ci - теплоемкости отдельных компонентов смеси; yi — объемное (молярное) содержание компонентов в долях единицы; 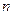 – число компонент.
– число компонент.
Связь молярной теплоемкости углеводородных и неуглеводородных компонент. При изобарическом процессе молярная теплоёмкость неуглеводородных компонентов природных газов (азота, углекислого газа, сероводорода) равна примерно половине теплоёмкости углеводорода с одинаковой молекулярной массой при одной и той же температуре.
Связь молярной теплоемкости с массовой. Массовая теплоёмкость равна отношению молярной теплоёмкости к молекулярной массе газа Mi, т.е. массе киломоля  -го компонента, кг/моль.
-го компонента, кг/моль.
Дата публикования: 2015-07-22; Прочитано: 2915 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
