 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Параметры состояния рабочего тела и их определение
|
|
Для определения конкретных физических условий, в которых находится термодинамическая система, используют ряд показателей, называемых параметрами состояния. В число основных параметров
входят: абсолютная температура, абсолютное давление и удельный объем.
Абсолютная температура –– это мера кинетической энергии движения молекул. Она характеризует
тепловое состояние тела. Температуру измеряют по абсолютной шкале в градусах Кельвина (К) и
обозначают буквой Т, либо по Международной практической системе единиц в градусах Цельсия (°С)
и обозначают t. В качестве реперной точки этих двух температур взята тройная точка чистой воды, при
которой все три фазы воды (лед, вода и пар) находятся в равновесии друг с другом. Температура в такой
точке соответствует значениям 273,15 К и 0,01°С. Таким образом, связь между единицами измерения
температуры в Кельвинах и Цельсиях можно выразить:
T = t + 273,15.
Абсолютное давление –– это средняя сила, с которой молекулы вещества действуют на единицу
площади сосуда. Обозначают абсолютное давление буквой р. Измеряют давление в ньютонах деленных на
квадратный метр Н/м2 или в паскалях Па (1Н/м2 =1Па). Так как эти единицы измерения для практических
целей очень малы, то давление может измеряться в барах
(1бар = 105Па). В технической системе
(МКГСС) за единицу силы принимают килограмм-силу (кгс), тогда единица измерения давления может
быть выражена кгс/м2 (1кгс/м2 = 9,8 Па). Эта единица измерения также мала, поэтому в технической
системе за единицу измерения давления принимают техническую атмосферу ат тех. (1 ат тех. = 10 4 кгс/м2 =
1кгс/см2 = 0,98 бар). Давление также измеряю высотой столба жидкости. Например:
1 ат тех = 735 мм рт. ст. = 10 м вод. ст. (при 0°С).
Следует сказать, что под действием давления и температуры столб жидкости может менять свой
объем, поэтому давление рабочего тела жидкостным столбом измеряют при нормальных физических
условиях (760 мм рт. ст. и 0 °С). В этом случае атмосферу называют физической.
1 ат физ. = 1,033 ат тех. = 760 мм рт. ст. = 101,3 кПа = 10,33 м вод. ст.
Под абсолютным давлением понимают действительное давление рабочего тела внутри сосуда.
Давление жидкостей, паров или газов обычно измеряют приборами барометрического типа, приборами
манометрического типа и вакуумметрами. Барометры измеряют давление окружающей среды В.
Манометры меряют разность между абсолютным давлением в сосуде и давлением в окружающей среды,
то есть избыточное давление ри. Следовательно, когда давление в сосуде превышает давление среды,
абсолютное давление рабочего тела будет определяться:
р = В + ри.
Вакуумметры показывают разность давления окружающей среды и абсолютного давления в сосуде,
то есть разряжение или вакуум рв. В этом случае абсолютное давление можно найти:
р = В − рв.
Удельный объем –– это объем, занимаемый рабочим телом массой 1 кг. Удельный объем
обозначают буквой v и измеряют в кубических метрах деленных на килограмм (м3/кг). Если V это объем
тела, м3, занимаемый массой М, кг, то
.
Обратной величиной удельному объему является плотность ρ (кг/м3): v = 1/ρ или v∙ρ =1.
В каждом конкретном случае все параметры состояния рабочего тела однозначно связаны друг
с другом. Зная эту зависимость и задавшись какими-либо двумя параметрами, можно найти остальные
неизвестные параметры. Метод их определения зависит от того, в каком виде –– аналитическом,
графическом или табличном –– представлена эта зависимость.
Аналитическая зависимость параметров состояния представляет собой уравнение состояния. Для
идеального газа используется уравнение
Менделеева-Клапейрона.
Для 1 кг газа оно запишется:
pv = RT.
Для газа массой М кг это уравнение примет вид:
pV = MRT.
v =V M
pVμ =
RT
μ
,
Для 1 киломоля газа:
где R –– газовая постоянная, независящая от состояния газа, Дж/(кг∙К); Vμ –– объем 1 киломоля газа, м3/
кмоль; μ –– молярная масса газа, кмоль.
Для многих реальных газов уравнение состояния имеет очень громоздкий вид и для расчетов такое
уравнение трудно использовать. Поэтому параметры состояния реальных газов, а также жидкостей
определяют табличным или графическим способом.
В таблицах заносят массив значений параметров состояния вещества, из которого выбираются
искомые значения при заданных двух параметрах состояния (обычно при температуре и давлении).
Для графического определения параметров состояния используют p-v, T-S и i-S диаграммы. На этих
диаграммах наносят семейства изобар, изохор, изотерм и адиабат. Одно из свойств таких диаграмм состоит
в том, что каждому состоянию рабочего тела соответствует точка на диаграмме. Для рассчитываемого
состояния она лежит на пересечении линий двух исходных параметров.
При подводе одного итого же количества теплоты к различным телам они изменяют свою
температуру на разную величину. Это происходит вследствие того, что тела обладают разной
теплоемкостью. Теплоемкостью называют количество теплоты, которое необходимо сообщить телу, чтобы
изменить его температуру на 1 градус.
В зависимости от того, в каких единицах задано количество вещества теплоемкость различают:
массовую с кДж/(кг∙К); объемную с/ кДж/(м3∙К); молярную сμ кДж/(кмоль∙К).
Связь между ними выражается следующей зависимостью:
==
ρ
ñ
μ
/ µ
.
Если –– q количества тепла, сообщаемого единице количества газа при изменении температуры газа
от Т1 до Т2 то величина
cm =
будет представлять собой среднюю теплоемкость в пределах Т1 – Т2.Тогда количество сообщенной телу теплоты будет определяться:=µ
QmcTTVcTTcnTT
mmm
()()()
2 −=−=−
/ 1í2121
,
где т –– масса газа, кг; Vн –– объем газа приведенный к нормальным физическим условиям, м3; п –– число
молей газа.
q
T2 − T1
Технической термодинамикой называется наука, изучающая свойства тепловой энергии и законы взаимного превращения тепловой и механической энергии. Она является основой теории двигателей внутреннего сгорания.
Процессы взаимного преобразования теплоты и работы в различных тепловых машинах осуществляются с помощью вещества, называемого рабочим телом. Например, в двигателях внутреннего сгорания (ДВС) и в газотурбинных установках рабочим телом является газ (воздух).
Физическое состояние рабочего тела характеризуется величинами, которые называют термодинамическими параметрами состояния. В качестве основных термодинамических параметров принимают удельный объем, абсолютное давление и абсолютную температуру.
Удельный объем (м3/кг) представляет собой объем единицы массы вещества:1.2. Параметры состояния рабочего тела и законы идеальных газов
Технической термодинамикой называется наука, изучающая свойства тепловой энергии и законы взаимного превращения тепловой и механической энергии. Она является основой теории двигателей внутреннего сгорания.
Процессы взаимного преобразования теплоты и работы в различных тепловых машинах осуществляются с помощью вещества, называемого рабочим телом. Например, в двигателях внутреннего сгорания (ДВС) и в газотурбинных установках рабочим телом является газ (воздух).
Физическое состояние рабочего тела характеризуется величинами, которые называют термодинамическими параметрами состояния. В качестве основных термодинамических параметров принимают удельный объем, абсолютное давление и абсолютную температуру.
Удельный объем (м3/кг) представляет собой объем единицы массы вещества:

где V— объем вещества, м3; т — масса вещества, кг.
Плотность (кг/м3) есть масса единицы объема, обратная удельному объему:
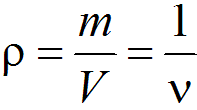
Давление газа обусловливается совокупностью ударов беспорядочно движущихся молекул о стенки сосуда, в котором заключен газ, и представляет собой силу, действующую на единицу площади поверхности стенки:

где Р — сила, Н; а — площадь поверхности, м2.
За единицу давления в Международной системе единиц (СИ) принят паскаль — давление, вызываемое силой 1 Н, равномерно распределенной по нормальной к ней поверхности площадью 1 м2. Применяют также укрупненные единицы: килопаскаль (кПа) и мегапаскаль (МПа):
1 Па = 1 Н/м2 = 10-3 кПа = 10-6 МПа.
В технике в настоящее время продолжают применять также систему единиц МКГСС (метр, килограмм-сила, секунда), в которой за единицу давления принимается 1кгс/м2. Используют также внесистемные единицы — техническую атмосферу и бар:
1 атм - 1 кгс/см2; 1 бар 105 Па = 1,02 атм; 1 кгс/м2 = 9,81 Па.
Различают абсолютное, избыточное и вакуумметрическое давление. На практике за начало отсчета обычно принимают атмосферное (барометрическое) давление. Абсолютным давлением называется давление газов и жидкостей в закрытых объемах. Если абсолютное давление больше атмосферного, то разность между ними характеризует избыточное (манометрическое) давление:
p абс = p атм + p изб
Если абсолютное давление меньше атмосферного, то разность между ними называется разрежением, или вакуумом:
p абс = p атм - p вак
Вышеприведенные формулы показывают, что при неизменном состоянии газа в сосуде постоянным остается лишь значение p абс, а p изб и p вак изменяются при изменении p атм. Поэтому параметром состояния газа служит только абсолютное давление, которое и входит во все термодинамические зависимости.
Температура представляет собой степень нагретости рабочего тела. Ее измеряют по международной стоградусной шкале Цельсия с обозначением t (°С), или абсолютной шкале Кельвина с обозначением T (К). Соотношение между температурой в Кельвинах и в градусах Цельсия следующее:
Т = t + 273,16.
Абсолютная температура, измеряемая в Кельвинах, является параметром состояния.
При изучении свойств рабочего тела в технической термодинамике вводят понятие идеального газа. При построении модели идеального газа придерживаются следующих положений:
-пренебрегают силами межмолекулярного взаимодействия;
-рассматривают молекулы газа как абсолютно упругие частицы, объем которых бесконечно мал по сравнению с объемом газа.
В технике в качестве рабочих тел применяют реальные газы и их смеси — О2, Н2, N2, СО2, NO3, перегретый водяной пар, атмосферный воздух и др. Реальный газ отличается от идеального тем, что у него молекулы имеют конечный объем и между ними действуют силы сцепления.
Газообразные продукты сгорания топлива, являясь рабочим телом в ДВС, по своим свойствам близки к идеальным газам, учитывая ту область состояний, в которой протекает процесс в двигателе. Поэтому в тепловых расчетах допустимо считать их идеальными газами.
В XVII—XIX вв. англичанин Р. Бойль, французы Э. Мариотт, Ж. Гей-Люссак, Ж. Шарль, итальянец А. Авогадро экспериментально установили ряд зависимостей, которые стали называться законами идеальных газов.
Закон Бойля — Мариотта.
При постоянной температуре удельные объемы данного газа обратно пропорциональны его абсолютным давлениям:

(при T =const) где индексы 1 и 2 относятся соответственно к начальному и конечному состоянию газа в процессе его расширения или сжатия.
Из закона следует что
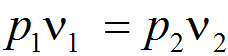
или

Закон Гей-Люссака.
При постоянном абсолютном давлении удельные объемы идеального газа прямо пропорциональны его абсолютным температурам:

при p = const.
Из этого следует:

при

Закон Шарля.
При постоянном объеме данной массы газа абсолютные давления идеального газа прямо пропорциональны его абсолютным температурам:
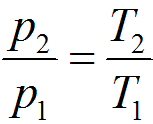
при

или

при
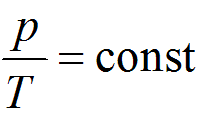
Закон Авогадро.
В равных объемах разных идеальных газов при одинаковых температуре и давлении содержится равное число молекул — число Авогадро (NA = 6,022 • 1023моль-1).
Под количеством вещества понимаем отношение числа молекул в данном теле к числу атомов в 0,012 кг углерода:
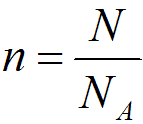
где n - число молекул в данном теле, шт.; NA - число Авогадро, моль-1.
Количество вещества измеряют в молях. Моль — это количество вещества, содержащее столько же молекул, сколько содержится атомов в 0,012 кг углерода. В Международной системе единиц (СИ) под молем понимают количество вещества в граммах, численно равное его молекулярной массе. Тысяча молей составляет один киломоль (1 кмоль = 103 моль).
Молярной массой вещества называется величина, равная отношению массы вещества к его количеству:

где m — масса вещества, г (кг); n — количество вещества, моль.
Молярная масса выражается в г/моль (кг/моль).
Объем одного киломоля при нормальных условиях для всех газов равен 22,4 м3 /кмоль. Отсюда следует, что можно легко определить удельный объем и плотность любого газа при нормальных условиях (p = 760 мм рт. ст. = 101,3 кПа и Т= 273 К):
 ;
; 
Для равновесного состояния газа, когда его термодинамические параметры р, V, T сколь угодно долго остаются неизменными, существует аналитическая зависимость, называемая уравнением состояния газа. Для произвольного количества вещества эта зависимость выражается уравнением Клайперона-Менделеева:
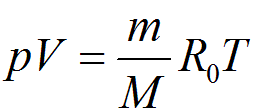
где V - объем данного количества вещества при давлении p и температуре T; m — масса вещества; М — молярная масса вещества; R0 — универсальная газовая постоянная (R0 = 8,315 кДж/(кмоль • К).
Для произвольной массы газа уравнение состояния идеального газа имеет вид уравнения Клапейрона:

где R – газовая постоянная, Дж/(кг• K).
Данная постоянная величина зависит от природы газа, но не зависит от его состояния, т.е. она является физической константой вещества.
Уравнение Клапейрона - Менделеева лежит в основе теплового расчета ДВС.
Дата публикования: 2014-10-25; Прочитано: 9517 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
