 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Особенности растворов биополимеров
|
|
Высокомолекулярные соединения могут образовывать как истинные, так и лиофильные коллоидные растворы. Характер раствора зависит от молекулярной массы макромолекул ВМС, их лиофильности и концентрации в системе. Чем больше концентрация ВМС и его молекулярная масса, а лиофильность макромолекул меньше, тем больше вероятность возникновения лиофильных коллоидных растворов, в которых макромолекулы образуют мицеллы. Общие свойства лиофильных коллоидных растворов уже рассмотрены (разд. 27.3.2). Теперь обратим внимание на особенности растворов биополимеров.
Важнейшими биополимерами являются белки, нуклеиновые кислоты и полисахариды, которые синтезируются в организме в результате реакции поликонденсации. Свойства этих высокомолекулярных соединений, и прежде всего биологические, зависят не только от того, какие структурные звенья входят в состав макромолекулы, но и от их взаимного пространственного расположения, т. е. от их конформации в растворе.
Конформации макромолекулы в растворе представляют собой различные ее пространственные формы, возникающие в результате вращения отдельных молекулярных фрагментов вокруг ординарных связей и стабилизирующиеся вследствие возникновения межмолекулярных связей между отдельными группами данной макромолекулы или с молекулами веществ, находящимися в окружающем растворе.
Взаимные переходы конформации макромолекул в растворе осуществляются без разрыва ковалентных связей, поэтому они обычно не требуют больших энергетических затрат, но могут приводить к значительным изменениям биологических и физиологических функций макромолекул. Таким образом, конформации молекул биополимеров в растворах изменяются в зависимости от состояния системы дисперсионная среда/биополимер. Состояние этой системы зависит от природы добавляемого реагента и от воздействия различных полей.
Набухание и растворение. В отличие от процесса растворения низкомолекулярного вещества, при котором происходит в основном диффузия растворяемого вещества в растворитель, начальная стадия процесса растворения ВМС заключается в диффузии молекул растворителя в объем полимера. Проникновение молекул растворителя в объем биополимера сопровождается процессом набухания.
Набухание - самопроизвольный процесс поглощения полимером растворителя, сопровождаемый увеличением объема и массы взятого образца ВМС.
Количественной мерой набухания является степень набухания a, которая может иметь объемное и массовое выражение, последнее дает более точный результат:

где V0 и V, т0 и т — соответственно объемы и массы исходного и набухшего образца полимера.
Степень набухания прежде всего зависит от природы полимера, т. е. от жесткости его цепей, обусловленной межмолекулярными взаимодействиями между ними, и лиофильности его макромолекул (сродства к растворителю). В зависимости от этих факторов и температуры набухание может быть ограниченным или неограниченным (рис. 27.12). При ограниченном набухании а достигает предельного значения, после чего не зависит от времени. Так набухают амилаза (составляющая крахмала) и желатин в теплой воде (Т * 50 °С). В этих случаях межмолекулярные взаимодействия в полимере достаточно сильны, и растворитель не в состоянии разобщить макромолекулы, поэтому набухание прекращается. В горячей воде для амилазы и желатина характерно неограниченное набухание, при этом значение а вначале возрастает, а затем падает до нуля в результате постепенного растворения желатина или амилазы.
Процесс набухания с позиции термодинамики характеризуется уменьшением энергии Гиббса
системы:  G =
G =  Н T
Н T  S < 0. В начале набухания происходит специфическое
S < 0. В начале набухания происходит специфическое
взаимодействие молекул растворителя и ВМС с образованием новых межмолекулярных связей.
Этот процесс экзотерми-чен (  Н < 0), а изменение энтропии незначительно (
Н < 0), а изменение энтропии незначительно ( S = 0).
S = 0).
 |
Рис. 27.12. Кинетика набухания различных ВМС
Даже в тех случаях, когда сольватация приводит к увеличению жесткости цепи и  S уменьшается, это изменение относительно невелико: |T
S уменьшается, это изменение относительно невелико: |T 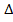 S| < |
S| < | 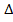 Н|, поэтому всегда
Н|, поэтому всегда  G < 0 (процесс самопроизвольный).
G < 0 (процесс самопроизвольный).
На заключительной стадии набухания, когда закончился процесс сольватации ВМС, энтальпия системы практически не изменяется ( Н = 0), но зато возрастает энтропия (
Н = 0), но зато возрастает энтропия ( S > 0). Это происходит потому, что разрыхление сетки ВМС приводит к частичному освобождению макромолекул (ограниченное набухание) или к переходу их в раствор (неограниченное набухание). Таким образом, система переходит из более упорядоченного состояния в менее упорядоченное. Следовательно, и заключительная стадия набухания характеризуется следующими неравенствами: T
S > 0). Это происходит потому, что разрыхление сетки ВМС приводит к частичному освобождению макромолекул (ограниченное набухание) или к переходу их в раствор (неограниченное набухание). Таким образом, система переходит из более упорядоченного состояния в менее упорядоченное. Следовательно, и заключительная стадия набухания характеризуется следующими неравенствами: T 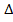 S > 0,
S > 0,  G * -T
G * -T 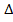 S < 0 (процесс также самопроизвольный).
S < 0 (процесс также самопроизвольный).
Степень набухания полимера, кроме упомянутых факторов, зависит от природы растворителя. В соответствии с правилом "подобное в подобном" полярные биополимеры - белки, нуклеиновые кислоты и полисахариды - в воде набухают лучше, чем в менее полярных растворителях (спирте и ацетоне).
На процесс набухания полимеров в воде влияет присутствие электролитов и значение рН среды. Влияние электролитов своеобразно прежде всего тем, что влияние оказывают в основном анионы, а катионы - лишь в незначительной степени. Причем одни анионы усиливают набухание, а другие ослабляют:

В целом этот ряд можно объяснить на основе изменения активности молекул воды в системе, а также поляризуемости обсуждаемых частиц. Следует обратить внимание на этот ряд и с позиции высаливания полимера из водного раствора (разд. 27.3.2).
Влияние рН среды на набухание полимера больше всего проявляется в растворах белков, поскольку их молекулы - по-лиамфолиты (рис. 27.13). Так, минимум набухания белков лежит в области их изоэлектрической точки рН = рI. По разные стороны от этой точки степень набухания возрастает и, достигнув максимумов, вновь уменьшается. Такое влияние рН на набухание связано с тем, что в изоэлектрической точке конформация макромолекул белка наиболее плотная и поэтому степень его гидратации, а следовательно, и склонность к набуханию и растворению минимальны. Появление максимумов в кислой и
 |
Рис. 27.13. Влияние рН раствора на набухание белков
щелочной среде связано с переходом белка в этих средах в катион или анион и разрыхлением его структуры из-за электростатического отталкивания одноименных зарядов. Таким образом, по зависимости степени набухания от рН можно определить изоэлектрическую точку белка.
Число и прочность межмолекулярных связей между макромолекулами и внутри них с течением времени увеличивается, и плотность системы возрастает. Поэтому на процесс набухания влияет возраст биополимера - чем он моложе, тем больше его степень набухания, т. е. тем больше он удерживает воды. Это находит полное подтверждение, если проследить за содержанием воды в организме человека, состоящем в основном из биополимеров. В начале утробной жизни эмбриона - в период интенсивного деления клеток и роста - система сильно удерживает воду и ее содержание составляет 95 % от массы эмбриона. У новорожденного содержание воды около 80 %, а у взрослого -60 %. Постепенное старение организма сопровождается замедлением процессов обмена, происходит буквальное усыхание человека, сопровождающееся появлением морщин, вследствие утраты способности клеток мышц и кожи к набуханию.
Вязкость. Вязкость растворов характеризует меру сопротивления среды движению. Вязкость растворов, содержащих макро молекулы, обычно значительно выше вязкости растворов низкомолекулярных соединений при тех же концентрациях. Это обусловлено тем, что цепь макромолекулы располагается во многих слоях жидкости и, сшивая их за счет межмолекулярных взаимодействий, препятствует перемещению относительно друг друга. Зависимость вязкости растворов полимеров от концентрации, температуры, давления не подчиняется обычным закономерностям. Особенности вязкости растворов ВМС объясняются изменением во времени конформации макромолекул, взаимодействием их между собой, образованием ассоциатов и структурированием системы в целом. Так, с повышением температуры вязкость растворов ВМС может изменяться по-разному. Если раствор образован сильно разветвленными молекулами, то вязкость раствора понижается с увеличением температуры вследствие уменьшения возможности структурирования. Вязкость растворов, содержащих длинные неразветвленные молекулярные цепи, с повышением температуры может повышаться из-за увеличения интенсивности движения фрагментов макромолекулы, что препятствует ориентации макромолекулы в потоке.
Вязкость водного раствора белка при рН = рI минимальна (как и его набухание), так как в этом случае конформации макромолекул наиболее компактны.
С течением времени в растворах биополимеров происходит значительное их структурирование, что, естественно, приводит к увеличению вязкости.
Таким образом, вязкость растворов ВМС сложным образом связана с формой и структурой макромолекул, а также характером межмолекулярных взаимодействий как внутри макромолекул, так и между ними. Это необходимо учитывать при работе с биологическими средами и при описании их движения в организме, особенно в капиллярах.
Осмотическое давление. Экспериментально определенное осмотическое давление для раствора ВМС заданной концентрации значительно превышает вычисленное по закону Вант-Гоффа. Это связано с тем, что макромолекула благодаря большим размерам и гибкости цепи ведет себя в растворе как несколько более коротких молекул. Поэтому роль кинетического элемента играет уже не вся макромолекула, а соответствующие ее сегменты, обладающие относительной подвижностью. Число подвижных сегментов возрастает с увеличением гибкости цепи макромолекулы и с ростом концентрации ВМС в растворе. Для расчета осмотического давления растворов ВМС используется уравнение Галлера:

где С - массовая концентрация ВМС в растворе, г/л; М - средняя молярная масса ВМС, г/моль; B - коэффициент, учитывающий гибкость и форму макромолекулы.
 |
Рис. 27.14. Зависимость π/С от концентрации раствора полимера
При небольших концентрациях полимера (B С2 -> 0) и для полимеров, молекулы которых имеют форму сферических глобул, например гемоглобина (B = 0), уравнение Галлера переходит в уравне ние Вант-Гоффа: π = RTC/M. Экспериментальное изучение влияния концентрации ВМС в растворе на его осмотическое давление позволяет с помощью графической зависимости величины π /С от С найти значения средней молярной массы полимера М и коэффициента Р, который численно равен значению tga (рис. 27.14).
В сложных биологических системах, содержащих неэлектролиты, электролиты и белки, каждый из этих компонентов вносит свой вклад в суммарное осмотическое давление. Вклад, обусловленный наличием белков, называется онкотическим давлением (разд. 6.4.2).
Мембранное равновесие Доннана. Наличие в клетке ионов белков, которые, в отличие от низкомолекулярных ионов обычных электролитов, не могут диффундировать сквозь мембрану, приводит к установлению мембранного равновесия Доннана.
 |
Мембранным равновесием Доннана называют равновесие, устанавливающееся в системе растворов, разделенных мембраной, непроницаемой хотя бы для одного вида ионов, присутствующих в системе. Условием этого равновесия является равенство произведения концентраций подвижных ионов по обе стороны мембраны.
Задерживаемый мембранойион может быть ионом любого полимера (полиэлектролита) или гранулой мицеллы лиофобного коллоидного раствора.
Рассмотрим биологическую систему клетка - наружный раствор (межклеточная жидкость). Допустим, что внутриклеточная жидкость содержит только соль белка, катионы которой способны проникать через клеточную мембрану, т. е. они подвижны, а анион белка задерживается мембраной (рис. 27.15). Наружный раствор содержит только подвижные ионы сильного электролита, причем общее число ионов пусть будет такое же, как внутри клетки. С учетом данного условия внутренний и наружный раствор должны быть изотоничны (π вн = π нар). Однако они не равновесны в отношении распределения подвижных ионов, способных к диффузии, по обе стороны мембраны.
 |
Рис. 27.15. Мембранное равновесие Доннана
В соответствии с законами диффузии сквозь мембрану прежде всего будут проникать подвижные анионы, увлекая за собой соответствующее число подвижных катионов. Движение катионов обусловлено не только диффузией, но и их электростатическим взаимодействием с анионами. Этот переход будет осуществляться до тех пор, пока произведение количества подвижных ионов по обе стороны мембраны не выравняется:
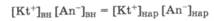
Именно это мы имеем в нашем примере при установлении мембранного равновесия Доннана:

Перераспределение подвижных ионов вследствие эффекта Доннана всегда приводит к повышению осмотического давления в клетке и уменьшению его снаружи. При этом внутриклеточный раствор становится гипертоническим по отношению к наружному, и тем самым клетка поддерживается в состоянии тургора. Кроме того, за счет присутствия в клетке солей белка сумма концентраций подвижных ионов внутри клетки всегда будет больше, чем в наружном растворе. Это обусловливает возникновение разности потенциалов между внутренней и наружной поверхностями мембраны, называемой мембранным потенциалом. Знак заряда внутренней поверхности мембраны будет совпадать со знаком заряда иона белка.
Таким образом, при мембранном равновесии Доннана осмотические (диффузионные) свойства системы уравновешиваются ее электростатическими свойствами.
Коацервация. В растворах с достаточно высокой концентрацией ВМС, особенно биополимеров, может происходить самопроизвольное расслоение на две несмешивающиеся фазы. Одна из них представляет собой концентрированный раствор полимера, называемый коацерватом, а другая - разбавленный раствор полимера. Это явление называется коацервацией. Вначале коацерват находится в исходном растворе в виде капель, а затем образуется сплошной слой (происходит расслоение системы). Процессу коацервации способствует не только высокая концентрация ВМС, но и факторы, вызывающие самопроизвольную агрегацию мицелл или макромолекул: введение в раствор электролитов или неэлектролитов, низкая температура, изменение рН среды, а также воздействие различных полей. Действие электролитов или неэлектролитов связано с их гидратацией, которая может происходить за счет молекул воды гидратных оболочек полимеров. В результате возникновения «оголенных» фрагментов у макромолекул происходит их дополнительная агрегация. Коацервация является процессом самоорганизации и структурирования органических веществ в водной среде в самостоятельную фазу. Самопроизвольное образование коацерватов в мировом океане лежит в основе гипотезы А.И. Опарина (1922) о происхождении жизни.
По мнению автора, явление коацервации внутри биологической системы под действием неполярных и малополярных веществ лежит в основе анестезии. Неэлектролиты, особенно летучие, легко проникают сквозь клеточные мембраны и, структурируя вокруг себя «рыхлую» воду, способствуют дегидратации молекул биосубстратов, включая те, из которых построены рецепторы. Это приводит к коацервации, т. е. к расслоению этих систем, с появлением новой границы раздела вокруг рецептора, служащей препятствием для диффузии катионов калия и натрия, необходимых для передачи нервного импульса от рецептора данной клетки к клеткам мозга (разд. 11.3).
Дата публикования: 2014-10-16; Прочитано: 7767 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
