 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Растворы амфолитов
|
|
Рассмотрим поведение амфолита HA- (например, HCO3-) в водном растворе.
HA- + H2O › H3O+ + A2- HA- + H3O+ › H2A + H2O

 и
и  , следовательно:
, следовательно:

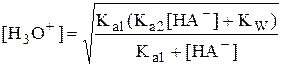
Если 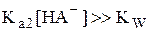 , то
, то

Если [HA-]» CHA- и [HA-] >> Ka1, то


Такие же формулы используются и для амфолитов типа BH+A-
Пример 4.4. Рассчитать рН 0,10 М NaHCO3 и 0,10 М HCOONH4
1) 
2) 
4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
Рассмотрим двухосновную кислоту H2A.



 =
=  =
=
= 
Молярные доли частиц будут равны:



В общем виде формула для расчёта молярной доли частицы  имеет следующий вид
имеет следующий вид

Для одноосновной кислоты


С учётом того, что  и
и  :
:


Из данных формул следует, что при рН = pKa a(HA) = a(A-) = 0,5. Если рН превышает рKa на 1, то молярная доля А- в 10 раз больше, чем HA, если на 2 - то в 100 раз, на 3 - в 1000 и т.д. При уменьшении рН аналогичным образом увеличивается a(HA) (рис. 4.3).
Если значения Ka для некоторой многоосновной кислоты отличаются друг от друга на 4 и более порядка, то можно считать, что при любом значении рН в равновесной смеси будут присутствовать только два вида частиц, а концентрация остальных пренебрежимо мала. Например, если необходимо рассчитать молярную долю молекул H3PO4 (pKa1 = 2,15; pKa2 = 7,21) при рН 3, то можно принять, что в равновесной смеси присутствуют только частицы H3PO4 и H2PO4-.Рассчёт можно провести по той же формуле, что и для одноосновной кислоты.

Рис. 4.3. Распределительная диаграмма для слабой кислоты (pKa = 5)
Пример 4.5. Рассчитать [NH3] в растворе с общей концентрацией аммиака 0,10 моль/л при рН 7,0.
 6,3×10-3
6,3×10-3
 М
М
Дата публикования: 2014-10-19; Прочитано: 965 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
