 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Степень гидролиза и константа гидролиза
|
|
Под степенью гидролиза понимают число h, показывающее какая часть от общего количества соли гидролизована.
Степень гидролиза определяется соотношением:
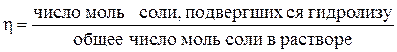
Познакомимся с вычислением степени гидролиза на примере KCN. Гидролиз этой соли может быть представлен следующим ионным уравнением:
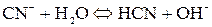 .
.
Напишем уравнение константы равновесия этой реакции:
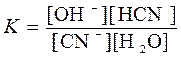 .
.
Величина [H2O] может считаться постоянной, т.к. вода находится в растворе в большом избытке. Перенесем её в левую часть уравнения:
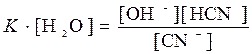 .
.
Произведение двух констант — это тоже константа, называемая константой гидролиза:
 . (10)
. (10)
Числовое значение К гидр можно найти из величины 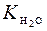 и
и  . Из ионного произведения воды:
. Из ионного произведения воды:

получим: 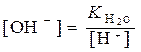 . (11)
. (11)
Подставим полученное выражение (11) для [OH–] в уравнение (10):
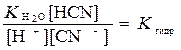
или 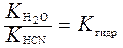 ,
,
где  — константа диссоциации цианистоводородной кислоты.
— константа диссоциации цианистоводородной кислоты.
Уравнение (10) будет иметь вид:
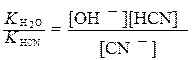 . (12)
. (12)
Из уравнения (12) определим степень гидролиза соли. Пусть концентрация соли С моль/л. Если степень гидролиза h, то гидролизовано С ∙hмоль соли и образовано С ∙hмоль HCN и С ∙h моль ионов ОН–:
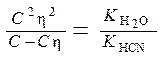 .
.
Следовательно: 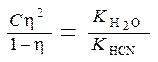 .
.
Так как величина h обычно мала по сравнению с единицей, то
 ;
;
 . (13)
. (13)
Полученное выше уравнение (13) подтверждает общие положения, что степень гидролиза тем больше:
а) чем больше  (т.е. чем выше температура), так как с ростом температуры ионное произведение воды (
(т.е. чем выше температура), так как с ростом температуры ионное произведение воды ( ) быстро растет);
) быстро растет);
б) чем меньше К кисл (т.е. чем слабей кислота, соль которой подвергается гидролизу);
в) чем меньше концентрация С, т.е. чем сильней разбавлен раствор.
Аналогично выводится формула для вычисления степени гидролиза солей сильных кислот и слабых оснований, например, NH4Cl:
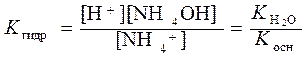 ;
;
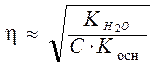 .
.
Дата публикования: 2014-11-18; Прочитано: 605 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
