 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1. В сторону прямой или обратной реакции сместится химическое равновесие в обратимом процессе
|
|
Пример 1. В сторону прямой или обратной реакции сместится химическое равновесие в обратимом процессе
N2 + 3H2 ←→ 2NH3
при повышении температуры равновесной системы, если прямая реакция является экзотермической?
Решение. В соответствии с принципом Ле-Шателье при повышении температуры ускоряется реакция, ослабляющая внешнее воздействие, т.е. протекающая с поглощением теплоты. В данном процессе это обратная реакция, и равновесие смещается влево.
Пример 2. При протекании в системе обратимой реакции:
А(г) + 2В(г) ←→ С(г)
в состоянии равновесия установились равновесные концентрации: [А]=0,06 моль/л; [В]=0,12моль/л; [С]=0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В, если в исходной смеси вещество C отсутствовало.
Решение. Константа равновесия данной реакции выражается уравнением:
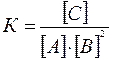 .
.
При подстановке в него данных задачи получаем:
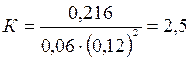 .
.
Для нахождения исходных концентраций веществ А и В учтем, что, согласно уравнению реакции, из 1 моля А и 2 моля В образуется 1 моль вещества С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моль вещества С, то расход вещества А к моменту достижения равновесия составил 0,216 моль, а расход вещества В составил 0,126 × 2 = 0,432 моль. Таким образом, искомые исходные концентрации равны:
[А0] = 0,06 + 0,216= 0,276 моль/ л;
[В0] = 0,12 + 0,432= 0,552 моль/ л.
Пример 3. Обратимая реакция протекает по уравнению:
2NО + О2 ←→ 2NО2.
Вычислить, во сколько раз изменятся скорости прямой и обратной реакций, если общее давление увеличить в 2 раза, и сделать вывод, в какую сторону сместится химическое равновесие?
Решение. Примем, что равновесные концентрации до увеличения давления составляли (моль/л): [NO]= a; [O2]= b; [NO2]= c. Тогда скорости прямой и обратной реакций будут равны:
υ 1 = k 1· a 2· b и υ 2 = k 2· c 2,
При увеличении давления в 2 раза концентрации участников реакции составят (моль/л): [NO]= 2 a; [O2]= 2 b; [NO2]= 2 c и скорости прямой и обратной реакций станут равны:
υ 1 = k 1·(2 a)2·2 b = k 1·8 a 2· b и υ 2 = k 2·(2 c)2, = k 2·4 c 2.
Найдем увеличение для скорости прямой и скорости обратной реакции:
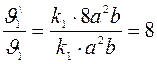 и
и 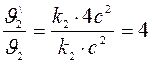 .
.
Таким образом, при увеличении давления в рассматриваемой равновесной системе в 2 раза скорость прямой реакции возрастает в 8 раз, а скорость обратной реакции в 4 раза, следовательно, равновесие сместится вправо — в сторону образования NO2.
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению:
PCl5 (г) ←→ PCl3 (г) + Cl2 (г); ΔН = +92,59 кДж.
Определить, как надо изменить температуру, давление, концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения PCl5.
Решение. Реакция разложения PCl5 эндотермическая, поэтому для смещения равновесия в сторону прямой реакции нужно повысить температуру. Разложение PCl5 ведет к увеличению объема системы, поскольку из одной молекулы газа образуется две молекулы газообразных веществ, следовательно, для смещения равновесия в сторону прямой реакции надо уменьшить давление. Смещение равновесия вправо можно обеспечить как увеличением концентрации PCl5, так и уменьшением концентраций PCl3 или Cl2.
Дата публикования: 2014-11-18; Прочитано: 1649 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
