 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1. Написать выражения закона действия масс для следующих реакций:
|
|
Пример 1. Написать выражения закона действия масс для следующих реакций:
а) 2NO(газ) + Сl2 (газ) = 2NOCl(газ) ;
б) CaCO3 (тверд.) = CaO (тверд.) + CO2 (газ) .
Решение.
а) Оба исходных реагента – газы, поэтому их концентрации войдут в выражение для скорости реакции в соответствии с формулировкой закона действия масс:
υ = k ·[NO]2·[Cl2].
б) Карбонат кальция – твердое вещество, концентрация которого не изменяется в ходе реакции, поэтому его концентрация в выражение закона действия масс не входит, а других исходных реагентов в данной реакции нет. Следовательно, выражение для скорости будет иметь вид:
υ = k,
и в данном случае скорость реакции (при постоянной температуре) будет постоянной величиной.
Пример 2. Как изменится скорость реакции 2СO + О2 = 2СО2, протекающей в закрытом сосуде, если увеличить давление в 2 раза?
Решение. Скорость указанной химической реакции определяется выражением:
υ нач = k ·[СО]2·[О2].
Увеличение давления приводит к увеличению концентрации обоих реагентов в 2 раза. С учетом этого перепишем выражение закона действующих масс:
υ 1 = k ·[2СО]2·[2О2] = k ·22[СО]2·2[О2] = 8 k ·[СО]2·[О2] = 8 υ нач .
Ответ: Скорость реакции увеличится в 8 раз.
Пример 3. Вычислить, во сколько раз увеличится скорость реакции, если повысить температуру системы от 20 °С до 100 °С,
приняв значение температурного коэффициента скорости реакции равным 3.
Решение. Отношение скоростей реакции при двух разных температурах связано с температурным коэффициентом и изменением температуры формулой:
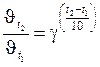 .
.
Вычисление:
 .
.
Ответ: Скорость реакции увеличится в 6561 раз.
Пример 4.. При изучении гомогенной реакции А + 2В = 3D установлено, что в течение 8 минут протекания реакции количество вещества А в реакторе уменьшилось с 5,6 моль, до 4,4 моль. Объем реакционной массы составлял 56 л. Вычислить среднюю скорость химической реакции за исследованный промежуток времени
по веществам А, В и D.
Решение. Используем формулу в соответствии с определением понятия «средняя скорость химической реакции» и подставляем численные значения, получая среднюю скорость по реагенту А:
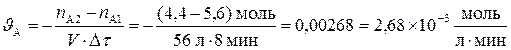 .
.
Из уравнения реакции следует, что по сравнению со скоростью убыли вещества А скорость убыли вещества В вдвое больше, а скорость увеличения количества продукта D — втрое больше.
Следовательно:
υ (А) = ½ υ (В) =⅓ υ (D)
и тогда υ (В) = 2 υ (А) = 2·2,68·10–3 = 6, 36·10–3 моль·л–1·мин–1;
υ (D) = 3 υ (А) = 3·2,68·10–3 = 8, 04·10–3 моль·л–1·мин–1.
Ответ: υ (А) =2,68·10–3 моль·л–1·мин–1;
υ (В) = 6, 36·10–3 моль·л–1·мин–1; υ (D) = 8, 04·10–3 моль·л–1·мин–1.
Дата публикования: 2014-11-18; Прочитано: 2816 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
