 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Краткие теоретические сведения. Кинетика изучает скорости и механизмы химических превращений
|
|
Кинетика изучает скорости и механизмы химических превращений. Скоростью реакции по данному компоненту называют изменение числа молей d ni этого компонента в единицу времени dt отнесенное для реакций, протекающих в объеме (или гомогенных), к единице объема V
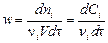 ,
,
где dCi – изменение концентрации вещества при условии V = const; n i – стехиометрический коэффициент, для исходных веществ n i < 0, а для продуктов реакции n i > 0.
Для реакций, протекающих на поверхности (гетерогенных), скорость относят к единице поверхности S:
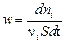 .
.
Скорость реакции зависит от исходной концентрации реагентов, температуры, удельной поверхности, наличия катализаторов, примесей и т.д.
Зависимость скорости процесса от концентрации реагирующих веществ описывается кинетическим уравнением или уравнением баланса масс. Для гипотетической реакции a A + b B = … кинетическое уравнение запишется следующим образом:
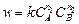 .
.
где k – константа скорости реакции, по физическому смыслу равная скорости реакции при единичных молярных концентрациях реагирующих веществ; величина k не зависит от концентрации реагирующих веществ, но показывает зависимость скорости реакции от температуры; показатели степени n 1 и n 2 являются порядком реакции по компонентам А и В соответственно; порядок реакции определяют из эксперимента путем математической обработки зависимости Сi = f (t), и величина порядка реакции (n S = n 1 + n 2) не обязательно представляет собой целое число.
Реакции, подчиняющиеся простым кинетическим уравнениям, бывают первого, второго или третьего порядков.
Порядок реакции можно установить, например, графически. Для этого из эксперимента получают зависимость концентрации вещества от времени, затем по экспериментальным данным строят зависимости: для первого порядка – ln C = f (t), для второго порядка – 1/ С = f (t), для третьего порядка – 1/ С 2 = f (t) и отмечают, какой из графиков будет представлять собой прямолинейную зависимость. Прямолинейная зависимость указывает на соответствующий порядок реакции.
Порядок и константа скорости реакции связаны между собой несложными соотношениями. Для реакции первого порядка 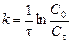 , второго порядка
, второго порядка 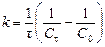 , третьего порядка
, третьего порядка 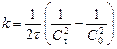 .
.
Таким образом, зная порядок реакции можно определить ее константу скорости и, в итоге, установить кинетическое уравнение данного химического процесса. Зная формулу кинетического уравнения можно выполнять математическое моделирование данного процесса с целью определить оптимальные условия проведения той или иной технологической операции.
Контрольные вопросы
1. Что изучает наука кинетика?
2. Что такое скорость реакции?
3. Какое уравнение описывает скорость гомогенного процесса?
4. Какое уравнение описывает скорость гетерогенного процесса?
5. Каким уравнением описывается зависимость скорости процесса от концентрации реагирующих веществ?
6. Что показывает константа скорости реакции и от чего зависит ее величина?
7. Что такое порядок реакции?
8. Какими способами можно определить порядок и константу скорости реакции?
Дата публикования: 2014-11-18; Прочитано: 439 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
