 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Краткие теоретические сведения. Термодинамические (коллигативные) свойства раствора зависят от концентрации и природы растворенного вещества
|
|
Термодинамические (коллигативные) свойства раствора зависят от концентрации и природы растворенного вещества, свойств растворителя, температуры, ионной силы раствора и др. К коллигативным свойствам, в частности, относятся понижение давления насыщенного пара растворителя, повышение температуры кипения раствора, понижение температуры замерзания и осмотическое давление.
Давление насыщенного пара растворителя над раствором всегда меньше, чем давление насыщенного пара над чистым растворителем при тех же температуре и общем давлении:
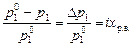 ,
,
где p 1 – давление насыщенного пара растворителя над раствором,  – давление насыщенного пара над чистым растворителем, x р.в. – мольная доля растворенного вещества; i – изотонический коэффициент, показывающий во сколько раз возрастает число частиц в растворе в результате диссоциации растворенного вещества.
– давление насыщенного пара над чистым растворителем, x р.в. – мольная доля растворенного вещества; i – изотонический коэффициент, показывающий во сколько раз возрастает число частиц в растворе в результате диссоциации растворенного вещества.
Раствор всегда кипит при температуре, большей, чем чистый растворитель:
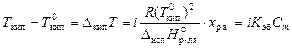 ,
,
где Т кип – температура кипения раствора;  – температура кипения чистого растворителя; R – универсальная газовая постоянная;
– температура кипения чистого растворителя; R – универсальная газовая постоянная; 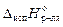 – молярная теплота испарения растворителя; x р.в. – мольная доля растворенного вещества; Cm – моляльная концентрация растворного вещества; K эб – эбуллиоскопическая постоянная растворителя (или константа кипения), которая может быть вычислена по формуле:
– молярная теплота испарения растворителя; x р.в. – мольная доля растворенного вещества; Cm – моляльная концентрация растворного вещества; K эб – эбуллиоскопическая постоянная растворителя (или константа кипения), которая может быть вычислена по формуле:
 ,
,
где М р-ля – молярная масса растворителя, кг/моль.
Эбуллиоскопическая постоянная для водных растворов равна 0,52 K∙кг‒1∙моль‒1.
Раствор замерзает при температуре меньшей, чем чистый растворитель:
 ,
,
где Т кр – температура кристаллизации раствора; 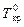 – температура кристаллизации (плавления) чистого растворителя; R – универсальная газовая постоянная;
– температура кристаллизации (плавления) чистого растворителя; R – универсальная газовая постоянная;  – молярная теплота плавления растворителя; x р.в. – мольная доля растворенного вещества; Cm – моляльная концентрация растворного вещества; K кр – криоскопическая постоянная растворителя (или константа замерзания), которую можно вычислить по уравнению:
– молярная теплота плавления растворителя; x р.в. – мольная доля растворенного вещества; Cm – моляльная концентрация растворного вещества; K кр – криоскопическая постоянная растворителя (или константа замерзания), которую можно вычислить по уравнению:
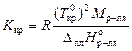 .
.
Для воды криоскопическая постоянная равна 1,86 K·кг/моль, для бензола – 5,07, диоксана – 4,71 и т.д.
Осмотическое давление:
 ,
,
где R – универсальная газовая постоянная; Т – температура; x р.в. – мольная доля растворенного вещества; СМ – молярная концентрация раствора, моль/л;  − молярный объем растворителя (объем 1 моль вещества), м3.
− молярный объем растворителя (объем 1 моль вещества), м3.
Термодинамические свойства предельно разбавленных растворов определяются свойствами чистого растворителя.
Численное значение изотонического коэффициента позволяет для электролитов вычислить степень диссоциации a:
 ,
,
где 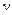 – число частиц, получающихся из одной частицы при диссоциации, например, для хлорида бария
– число частиц, получающихся из одной частицы при диссоциации, например, для хлорида бария 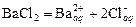
 .
.
Для слабых электролитов величина a является степенью диссоциации в классическом понимании этого термина. Для сильных электролитов по этой же формуле вычисляют величину кажущейся степени диссоциации или средний ионного коэййициента активности.
Если вещество в растворе ассоциировано, то значение изотонического коэффициента позволяет вычислить степень ассоциации:
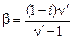 ,
,
где  – число частиц, объединяющихся в одну при ассоциации.
– число частиц, объединяющихся в одну при ассоциации.
По данным измерений давления пара, осмотического давления, темепературы замерзания или кипения можно вычислить, зная массы растворенного вещества и растворителя, молярную массу расвторенного вещества, степень диссоциации слабого электролита, средний ионный коэффициент активности для сильного электролита. По данным измерений температуры замерзания или кипения, можно, кроме того, рассчитать молярную массу и теплоту плавления или испарения растворителя.
Контрольные вопросы
1. Как изменяется давление насыщенного пара растворителя при переходе от чистого растворителя к раствору?
2. Как изменение давления насыщенного пара растворителя связано с концентрацией раствора?
3. Как сказывается изменение концентрации раствора на его температуре кипения?
4. Какое уравнение отображает зависимость температуры кипения раствора от концентрации растворенного вещества?
5. Как сказывается изменение концентрации раствора на его температуре кристаллизации?
6. Какое уравнение отображает зависимость температуры кристаллизации раствора от концентрации растворенного вещества?
7. Каким уравнением связаны криоскопическая постоянная растворителя и его термодинамические характеристики?
8. Каким уравнением связаны эбуллиоскопическая постоянная растворителя и его молярная масса?
9. Каким уравнением описывается зависимость осмотического давления от концентрации раствора?
10. С какой целью в уравнения коллигативных свойств растворов был добавлен изотонический коэффициент?
11. Что показывает изотонический коэффициент?
12. Как изотонический коэффициент связан со степенью диссоциации или ассоциации вещества в растворе?
Дата публикования: 2014-11-18; Прочитано: 478 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
