 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Краткие теоретические сведения. Термохимия – раздел физической химии, изучающий тепловые эффекты химических реакций и других физико-химических процессов (адсорбция
|
|
Термохимия – раздел физической химии, изучающий тепловые эффекты химических реакций и других физико-химических процессов (адсорбция, фазовые превращения, процессы растворения и др.), а также теплоемкости веществ и зависимости этих свойств от различных параметров состояния: температуры, давления, концентрации реагентов, удельной поверхности и т.д. В настоящее время тепловой эффект многих реакций может быть вычислен по справочным данным в соответствии с законом Гесса. Однако грамотный специалист должен быть знаком с практическими методами определения теплового эффекта.
Термохимические измерения проводят в калориметрах. Простейшая калориметрическая система представляет собой реакционный сосуд чаще всего с изотермической оболочкой, в которой проводят изучаемый процесс. Простейший калориметр с изотермической оболочкой представляет собой стеклянный стакан, поставленный для уменьшения теплообмена в другой стеклянный или фарфоровый стакан на подставку и снабженный крышкой. Перемешивание раствора осуществляется стеклянной палочкой – мешалкой. Температура системы измеряется при помощи термометра Бекмана. Реагирующее вещество может быть помещено в систему в виде раствора при помощи пипетки, либо в сухом виде засыпано через отверстие в крышке калориметра.
Измерение теплового эффекта реакции основано на первом начале термодинамики. Энтальпия калориметрической системы Hcal постоянна и складывается из изотермического теплового эффекта D rH при начальной температуре T н и теплоемкости калориметрической системы при нагревании до конечной температуры T к:
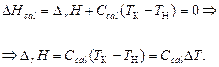
Таким образом, для определения теплового эффекта реакции необходимо знать теплоемкость системы С cal и вызванное реакцией изменение температуры D Т.
Теплоемкость системы может быть определена экспериментально путем сообщения системе определенного количества тепла или вычислена простым суммированием теплоемкостей различных частей калориметрической системы:
 ,
,
где Сi и mi – удельные теплоемкости и массы рабочих растворов и деталей, из которых состоит калориметрическая система.
Основная погрешность, возникающая при использовании расчетного метода определения теплоемкости калориметра, состоит в определении границ калориметрической системы. Так, например, включая в калориметрическую систему мешалку и пипетку целиком, мы не учитываем, что их верхние части выходят за пределы калориметра, и не нагреваются до конечной температуры системы. Экспериментальный метод более трудоемкий, зато лишен этого недостатка.
Изменение температуры системы D Т обычно определяется при помощи термометра Бекмана с ценой деления 0,01 K. Ввиду высокой чувствительности термометра вся шкала его обычно рассчитана на измерение интервала температур 5 K. Перед началом измерений термометр обычно настраивают на заданный диапазон температур, используя запасной верхний резервуар, грубо калиброванный в градусах Цельсия. Если ожидается эндотермический эффект, термометр при начальной температуре опыта должен показывать 4°, при ожидании экзотермического эффекта – 1° Бекмана, если тепловой эффект заранее не известен, то столбик ртути должен находиться на уровне 2-3°Б.
Измерение температуры ведут в три этапа: начальный период, главный период и конечный период. До начала опыта все части калориметрической системы должны приобрести одинаковую температуру, что достигается путем перемешивания раствора не менее 2-3 мин. В результате теплообмена с окружающей средой наблюдается небольшое изменение температуры системы, которое надо учитывать при дальнейших расчетах. Для определения температурного хода начального периода измеряют температуру калориметрической системы при постоянном перемешивании раствора в течение 5 мин. с временным интервалом 30 с. Перед проведением начального периода следует убедиться, что температура системы либо совсем не меняется, либо изменяется равномерно (незначительно растет или уменьшается).
По завершении измерения начального периода, не прерывая отсчета времени и измерений температуры, приступают к выполнению главного периода: выливают раствор из пипетки, либо добавляют в реакционную систему сухое вещество. Главный период сопровождается значительным изменением температуры и соответствует протеканию химической реакции. Продолжительность главного периода обычно составляет 1-3 мин.
Заключительный период – система приходит в состояние равновесия. Наблюдается постоянство температуры, либо незначительное изменение температуры, как правило, в сторону, противоположную изменению температуры в главном периоде. Для определения изменения температуры во время заключительного периода проводят измерения температуры при постоянном перемешивании в течение 10 мин. через каждые 30 с., затем определяют грницу между главным и заключительным периодом, соответствующую установлению равномерного изменения температуры.
Для определения поправок на теплообмен и разности температур предлагается использовать графический метод, предложенный проф. К.П.Мищенко. В первой половине главного периода теплообмен продолжается с той же скоростью, что и в начальном периоде, а во второй – с той же скоростью, что и в конечном периоде. Величину D Т определяют как разность между двумя температурами, которые имела бы система в случае мгновенного протекания реакции и в момент времени, соответствующий середине главного периода.
После определения Сcal и D Т рассчитывают наблюдавшийся в реакции тепловой эффект и относят его к числу молей вещества, принявших в ней участие:
 .
.
Для реакции нейтрализации используют число молей вещества, находившегося в пипетке. Для реакций растворения тепловой эффект относят к числу молей растворенной соли.
Для реакции взаимодействия сильной кислоты со щелочью величина D rH соответствует ионному уравнению:
 .
.
При нейтрализации слабых кислот или оснований значение теплоты нейтрализации может существенно отличаться от стандартного, т.к. в этом случае процесс можно разделить на две стадии:
1) диссоциация слабого электролита:
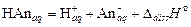 ;
;
2) собственно нейтрализация:
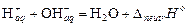 .
.
В данном случае тепловой эффект реакции является суммой указанных процессов:
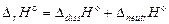 .
.
Следовательно, теплота диссоциации может быть вычислена как разность теплового эффекта реакции слабой кисоты и щелочи и теплового эффекта реакции нейтрализации.
При растворении соли 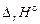 является интегральной теплотой растворения соли
является интегральной теплотой растворения соли 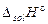 , т.е. теплотой образования раствора конечной концентрации из соли и воды.
, т.е. теплотой образования раствора конечной концентрации из соли и воды.
Для реакции образования кристаллогидрата следует рассмотреть другой цикл. Например, для определения 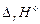 образования CuSO4·5H2O из безводного сульфата меди и 5 молекул воды можно экспериментально определить два тепловых эффекта: растворения безводной соли
образования CuSO4·5H2O из безводного сульфата меди и 5 молекул воды можно экспериментально определить два тепловых эффекта: растворения безводной соли
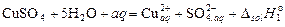 (*)
(*)
и растворения кристаллогидрата
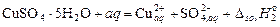 . (**)
. (**)
Если вычесть уравнение (**) из уравнения (*), то получим реакцию образования кристаллогидрата (гидратообразования)
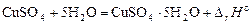 ,
,
где 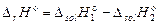 .
.
Таким образом, искомый тепловой эффект реакции гидратообразования может быть определен как разность теплот растворения моля безводной соли и моля кристаллогидрата с образованием растворов одинаковой концентрации.
Контрольные вопросы
1. От каких параметров зависит тепловой эффект реакции и теплоемкость?
2. Из каких основных частей состоит простейшая калориметрическая система?
3. На каком законе термодинамики основано измерение теплового эффекта реакции?
4. Как рассчитывается  ?
?
5. Какие величины надо знать или экспериментально определить для установления теплового эффекта реакции?
6. Как можно определить теплоемкость системы? Недостаток расчетного метода.
7. Какие этапы можно выделить при проведении термохимических измерений? Краткая характеристика каждого этапа.
8. Каким образом можно определить окончание главного периода?
9. Какие составляющие входят в величину теплового эффекта реакции нейтрализации слабого электролита?
10. Как можно определить тепловой эффект процесса гидратообразования?
Дата публикования: 2014-11-18; Прочитано: 511 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
