 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Работа расширения идеального газа
|
|
Учитывая выведенное раннее разделение полной работы процесса на работу расширения и полезную работу (см. 1.6 и 1.10), математическое выражение первого закона термодинамики (2.3) можно представить в виде:
dq = dU + dW’+ pdV. (2.5)
Равенство (2.5) может служить основой для расчётов тепловых эффектов (теплот) любых процессов. Для упрощения будем считать, что рассматриваемая система не производит других видов работы, кроме работы расширения, т. е. dW’ = 0. Тогда уравнение первого закона термодинамики приобретёт вид:
dq = dU + pdV. (2.6)
При изобарном процесе (р = const) давление можно ввести под знак дифференциала и, следовательно, рdV = d (рV). Таким образом, правая часть равенства (2.6) состоит из суммы полных дифференциалов, которая, как известно из математики, также является полным дифференциалом некоторой функции Н – энтальпии:
dq = dU + d (pV) = d (U + pV) = dH. (2.7)
Таким образом, теплота изобарного процесса оказывается равной приращению функции состояния энтальпии (Н), что позволяет перейти от бесконечно малого приращения к конечному.
2 2
qр = òdqp = òdH = H2 – H1 = DH. (2.8)
1 1
Энтальпия является функцией состояния и связана с внутренней энергией уравнением: Н = U + pV. (2.9)
Как следует из равенства (2.8) приращение энтальпии DН равно теплоте изобарного процесса, т. е. для определения теплоты изобарного процесса достаточно знать значения энтальпии системы в её начальном и конечном состоянии.
Наиболее простой путь определения энтальпии основан на измерении теплоёмкости тел при постоянном давлении. Действительно, теплоёмкость есть отношение количества сообщённой телу теплоты к приращению температуры тела:
C =  . (2.10)
. (2.10)
Для случая Р = const имеем:
Cp = 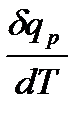 =
= 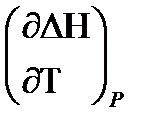 . (2.11)
. (2.11)
Состояние тела может быть однозначно задано двумя параметрами, например, давлением и температурой. Следовательно, функция состояния
Н = f (Р, T).
Н зависит от двух переменных, и её полный дифференциал имеет вид:
dH = 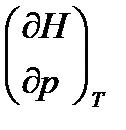 dp +
dp + 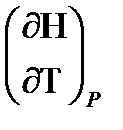 dT. (2.12)
dT. (2.12)
Для изобарных процессов первый член правой части равен нулю, т. к. dp = 0, а второй, согласно (2.11) содержит величину изобарной теплоёмкости (Ср). Отсюда, сделав соответствующую замену, и интегрируя уравнение: dH = òCp dT получаем:
qP = DH = Cp(T2 – T1). (2.13)
При изохорном процессе V = const, dV = 0 и равенство (2.6) примет вид:
dqv = dU. (2.14)
После интегрирования уравнения (2.14) от состояния “1” до состояния “2” получаем для конечного процесса:
qv = U2 – U1 = DU. (2.15)
Т. е. теплота изохорного процесса равна приращению внутренней энергии. Аналогично энтальпии, внутренняя энергия может быть найдена по теплоёмкостям, измеренным при постоянном объёме. Вывод уравнений аналогичен вышеприведённому.
dU =  +
+ 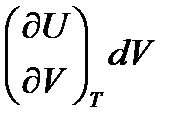 ,
,
Cv =  =
= 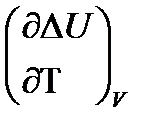 , (2.16)
, (2.16)
dU = òCv dT,
Тогда согласно (2,14)
qV = DU = CV(T2 – T1). (2.17)
Теплоемкость. Виды теплоемкости. Связь между средней и истинной теплоемкостью. Теплоемкость при постоянном давлении и объеме и связь между ними. Температурная зависимость теплоемкости от температуры.
Дата публикования: 2014-11-18; Прочитано: 541 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
