 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Расчет тепловых эффектов химических реакций по теплотам образования и теплотам сгорания веществ (на примере реакции)
|
|
Измерение тепловых эффектов возможно при соблюдении двух условий:
1) когда в системе протекает только одна реакция;
2) реакция протекает до конца достаточно быстро, так что теплота за время ее измерения не успевает рассеиваться в окружающую среду.
При расчетах тепловых эффектов химических реакций на основе закона Гесса особое значение имеют два вида тепловых эффектов – теплота образования и теплота сгорания.
Теплотой образования называется тепловой эффект реакции образования 1 моль данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию элементов при данной температуре. Например, теплота образования СаСО3 равна тепловому эффекту реакции образования карбоната кальция в данной его кристаллической модификации из металлического кальция, углерода (графит) и газообразного кислорода:
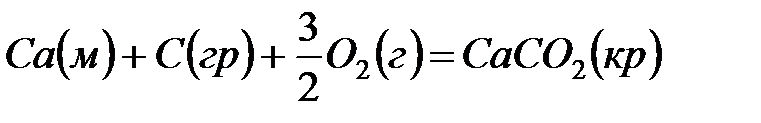 .
.
Теплоту образования относят к одному молю соединения при температуре 250С и называют стандартной теплотой образования 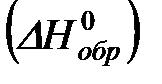 . Тепловой эффект любой химической реакции можно легко рассчитать, если известны теплоты образования всех веществ, участвующих в реакции. Из закона Гесса следует, что тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения, и теплотами образования всех веществ, указанных в левой части уравнения реакции, взятых с соответствующими стехиометрическими коэффициентами.
. Тепловой эффект любой химической реакции можно легко рассчитать, если известны теплоты образования всех веществ, участвующих в реакции. Из закона Гесса следует, что тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения, и теплотами образования всех веществ, указанных в левой части уравнения реакции, взятых с соответствующими стехиометрическими коэффициентами.
Например, дана реакция
b B + d D = g G + r R + 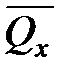 дж.
дж.
Обозначим теплоты образования соответственно через 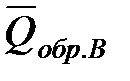 ,
, 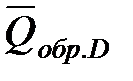 ,
, 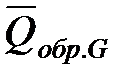 ,
,  .
.
Тепловой эффект реакции
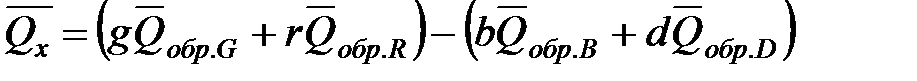 ,
,
или в общем случае
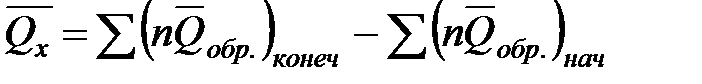 ;
;
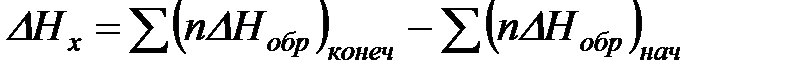 .
.
Теплотой сгорания называется тепловой эффект реакции окисления 1 моль данного соединения кислородом с образованием высших окислов соответствующих элементов. Для органических соединений теплотой сгорания называется тепловой эффект реакции полного сгорания данного соединения до углекислого газа, водяных паров и других продуктов.
Отнесенная к 250С, теплота сгорания называется стандартной теплотой сгорания 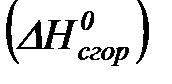 .
.
Если известны теплоты сгорания всех веществ, участвующих в реакции, то можно рассчитать тепловой эффект самой реакции.
Из закона Гесса следует, что тепловой эффект реакции равен разности между теплотами сгорания веществ, указанных в левой части уравнения, и теплотами сгорания веществ, указанных в правой части уравнения, взятых с соответствующими стехиометрическими коэффициентами.
Для реакции b B + d D = g G + r R + 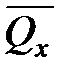 , если теплоты сгорания обозначим соответственно
, если теплоты сгорания обозначим соответственно
 ,
, 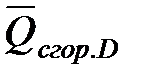 ,
, 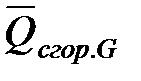 ,
, 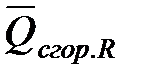 ,
,
тепловой эффект 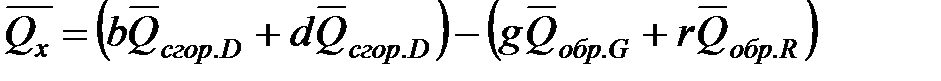 .
.
В общем виде 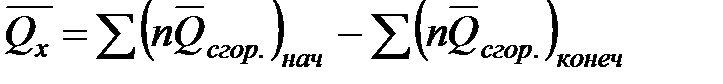 ;
;
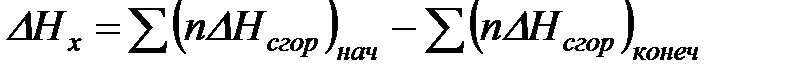 .
.
Заметим, что в обоих случаях теплоты образования и сгорания должны определяться в одинаковых условиях – или в изобарных, или изохорных. Изобарные и изохорные стандартные теплоты образования и сгорания многих соединений можно найти в справочниках.
Для приближенного расчета тепловых эффектов существует целый ряд эмпирических закономерностей. Например, для расчета теплот сгорания органических веществ применяется приближенная формула, предложенная Д. П. Коноваловым
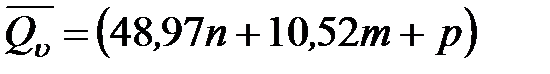 ккал/моль,
ккал/моль,
где n – число атомов кислорода, требующихся для полного сгорания данного вещества; m – число молей образующейся жидкой воды; р - поправочная величина, названная Коноваловым термической характеристикой. Постоянный коэффициент 48,97 выражает теплоту полного сгорания угля в расчете на один грамм-атом кислорода, а коэффициент 10,52 – теплоту конденсации образующихся водяных паров. Для соединения, имеющего эмпирическую формулу СхНуОz,
 и
и 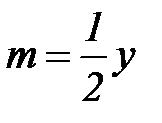 .
.
Для всех предельных органических соединений р = 0. Для непредельных соединений р ≠ 0. Значение этой величины является постоянным для всех членов данного гомологического ряда и растет с повышением непредельности; например, для соединений ацетиленового ряда р = 51.
Дата публикования: 2014-11-18; Прочитано: 3286 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
