 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Экспериментальная часть. 3.1. Реактивы и аппаратура
|
|
3.1. Реактивы и аппаратура
1. п -нитробензойная кислота, ч
2. м -нитробензойная кислота
3. 4-метилбензойная кислота
4. п -бромбензойная кислота
5. Нитробензол, ч
6. Цинковая пыль
7. Хлорид натрия, хч
8. Метаванадат аммония, чда
9. Соль Мора, 0,02 М
10. Фенилантраниловая кислота, ч
11. Фосфорная кислота, хч
12. Хлороформ, ч, перегнан при 64оС
13. Ионообменная смола КУ-2 в Н+ форме
14. Ионообменная смола Амберлит в Cl- форме
1. Фотометрические измерения производили на спектрофотометре модели UV mini – 1240 фирмы “Shimadzu” в кюветах с толщиной слоя 10 мм в области длин волн 400 – 700 нм. Раствор сравнения хлороформ.
2. Упаривание проб природных вод производили на электрической плитке.
3. Взятие навесок осуществляли с помощью весов аналитических ВЛР–200.
3.2. Использованные растворы.
1. Стандартный раствор ванадия (V), Cv = 0,829 г/л
Раствор готовили растворением навески (m = 2,3934 г) ванадата аммония в 60 мл 0.5 М H2SO4 и доведением объема раствора до 1 л дистиллированной водой. Стандартизацию раствора осуществляли титрованием стандартным раствором соли Мора с индикатором фенилантраниловой кислотой. Рабочие растворы с меньшими концентрациями V(V) готовили разбавлением исходного раствора дистиллированной водой непосредственно перед использованием.
2. Растворы реагентов в хлороформе, С = 2,00 г/л.
Растворы готовили растворением навесок сухих реагентов (m = 0,1000 г) в 50 мл хлороформа.
3.3. Синтез N-фенилгидроксиламина (N-БФГА)
3.3.1. Получение фенилгидроксиламина.
К раствору 5г хлористого аммония в 160 мл воды добавляют при перемешивании 10 мл нитробензола, а затем маленькими порциями 13 г цинковой пыли в течении 15 – 20 минут. Реакция восстановления сопровождается повышением температуры реакционной массы до 60 – 65°С. Реакционную массу выдерживают при этой температуре в течение 10 – 15 минут, а затем фильтруют для удаления гидроокиси цинка, которую затем промывают небольшим количеством горячей воды. Фильтрат и промывные воды насыщают хлористым натрием (50г; необходимо следить за тем, чтобы хлористый натрий целиком растворился), охлаждают до 0°С и выдерживают при этой температуре не менее 0.5 часа. Выпавший фенилгидроксиламин быстро отфильтровывают, хорошо отжимают и используют для конденсации с хлористым бензоилом. Вес сырого продукта 11,8 г (93% теории, принимая во внимание, что влажность его составляет 30%).
3.3.2. Получение хлористого бензоила.
Кипятят 0,1 моль карбоновой кислоты и 0,15 моля тионилхлорида (на каждую карбоксильную группу) с обратным холодильником до прекращения выделения газа. Затем избыток тионилхлорида отгоняют на водяной бане. Образовавшийся хлорангидрид перегоняют под вакуумом.
3.3.3.Получение N-бензоилфенилгидроксиламина.
В колбе растворяют 6,7 г сырого, хорошо отжатого фенилгидроксиламина в 200 мл теплой воды (40°С); полученный раствор отфильтровывают. Фильтрат, охлажденный до 10°С, подщелачивают бикарбонатом натрия до слабощелочной реакции и при энергичном размешивании к нему по каплям добавляют 7,8 г бензоилхлорида. После добавления всего количества хлористого бензоила реакционную массу выдерживают при перемешивании в течение 1,5 часов. Далее, выпавшую смесь моно- и дибензоильных производных отфильтровывают, выделенный осадок тщательно растирают с бикарбонатом натрия и небольшим количеством воды, фильтруют и промывают водой до удаления запаха хлористого бензоила. Монобензоильное производное отделяют от дибензоильного обработкой смеси раствором аммиака, в котором растворяется только монобензоилфенилгидроксиламин. Массу отфильтровывают, а фильтрат приливают при размешивании к избытку раствора серной кислоты (1:1). Полученные белые кристаллы бензоилфенилгидроксиламина отфильтровывают, промывают холодной водой до отсутствия кислой реакции в промывных водах и хорошо отжимают. Полученный продукт перекристаллизовывают из этилового спирта. Вес продукта 0.84 г (16% теории).
3.4.Синтез реагентов
По приведенной выше методике было получено несколько различных реагентов для определения ванадия (V):
1. N-4-метилбензоилфенилгидроксиламин (N-МБФГА)

В синтезе N-МБФГА в качестве карбоновой кислоты использовалась 4-метилбензойная кислота.
2. N- п -бромбензоилфенилгидроксиламин (N-ББФГА)
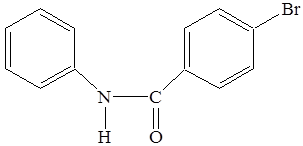
Для получения N-ББФГА использовалась п -бромбензойная кислота.
3. N- п -нитробензоидфенилгидроксиламин

Для получения п -нитробензоидфенилгидроксиламина использовалась п -нитробензойная кислота.
4. N- м -нитробензоилфенилгидроксиламин
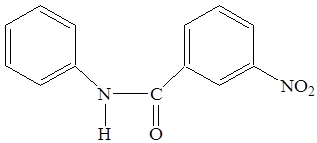
Для синтеза м -нитробензоилфенилгидроксиламина использовалась м -нитробензойная кислота.
5. N-циннамоилфенилгидроксиламин (N-ЦФГА)

Для получения N-ЦФГА использовалась коричная кислота.
Все полученные реагенты были перекристаллизованы из этанола и высушены. Для идентификации синтезированных веществ были получены их ЯМР – спектры. спектры
3.5.Методика эксперимента.
Экстракционно-фотометрический метод определения ванадия(V) с N-БФГА основан на образовании окрашенного в фиолетовый цвет комплексного соединения ванадия(V) с N-бензоилфенилгидроксиламином в растворе соляной кислоты, экстрагировании его хлороформом и измерении оптической плотности окрашенного органического раствора при длине волны 530 нм. Порядок прибавления реактивов следующий: к раствору ванадия(V) последовательно добавляли: 12 мл 6М раствора соляной кислоты, дистиллированную воду до 30 мл и 3 мл хлороформенного раствора реагента. После тщательного перемешивания и отстаивания хлороформенный экстракт сливали и измеряли его оптическую плотность относительно хлороформенного раствора реагента на спектрофотометре при 530 нм и толщине слоя 10 мм. Спектры хлороформенных экстрактов комплексов ванадия (V) с реагентами представлены ниже.
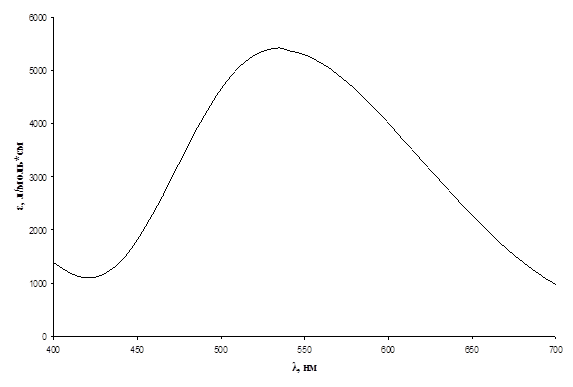
Рис.1. Спектр хлороформенного экстракта комплекса ванадий(V) – N-4-метилбензоилфенилгидроксиламин, Cv = 0,825 мг/л.

Рис.2. Спектр хлороформенного экстракта комплекса ванадий(V) – N-п-бромбензоилфенилгидроксиламин, Cv = 0,825 мг/л.
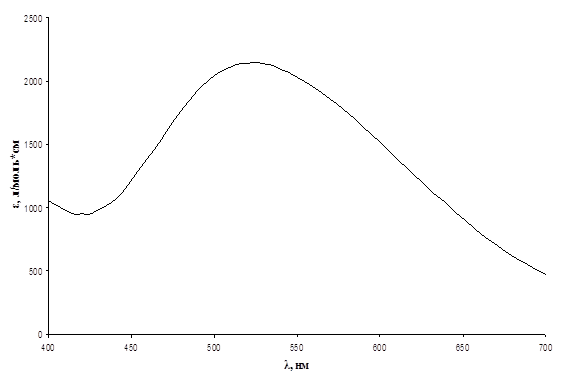
Рис.3. Спектр хлороформенного экстракта комплекса ванадий(V) – N-п-нитробензоилфенилгидроксиламин, Cv = 0,825 мг/л.
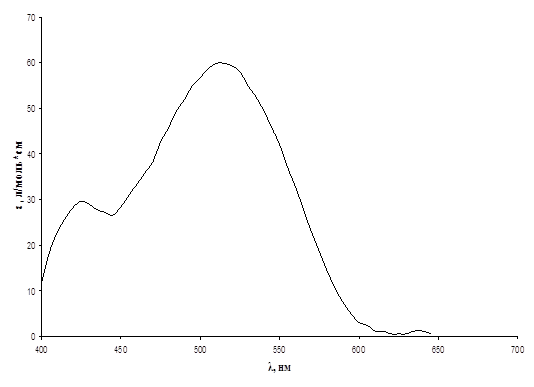
Рис.4. Спектр хлороформенного экстракта комплекса ванадий(V) – N-м-нитробензоилфенилгидроксиламин, Cv = 8,25 мг/л.
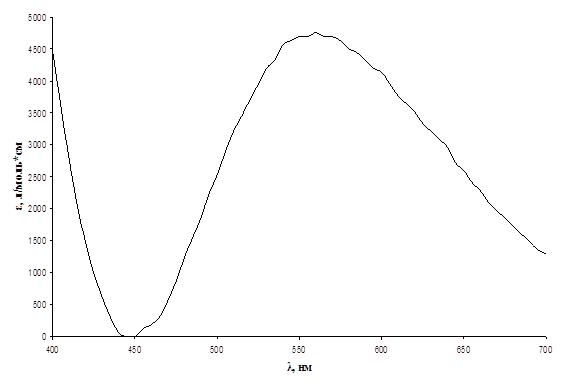
Рис.5. Спектр хлороформенного экстракта комплекса ванадий(V) – N-циннамоилфенилгидроксиламин, Cv = 0,825 мг/л.
Из данных спектров видно, что хлороформенные экстракты комплексных соединений ванадия(V) поглощают свет в видимой области спектра. Максимум поглощения для комплекса с N-4-метилбензоилфенилгидроксиламином имеет место в области 530 – 540 нм, при этом коэффициент экстинкции ε ~ 5500 л/моль*см; для комплекса с N-п-бромбензоилфенилгидроксиламинов – в области 520 – 530 нм, е ~ 3500 л/моль*см; для комплекса с N-п-нитробензоилфенилгидроксиламинов – в области 520 – 530 нм, е ~ 2200 л/моль*см; для комплекса с N-м-нитробензоилфенилгидроксиламинов – в области 510 – 520 нм, е ~ 60 л/моль*см; для комплекса с N-циннамолфенилгидроксиламином – в области 550 – 560 нм, е ~ 4700 л/моль*см. Таким образом, наименьшее значение коэффициента экстинкции имеет комплекс ванадий (V) - N-м-нитробензоилфенилгидроксиламин, и поэтому данный реагент не представляет дальнейшего интереса.
Для получения более подробной информации о значениях коэффициентов экстинкции комплексов ванадия (V) с реагентами, были построены градуировочные графики.ПОЧЕМУ ТОЛЬКО ТРИ ТОЧКИ?
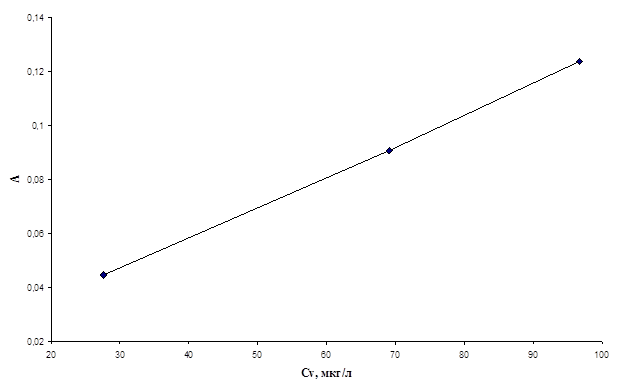
Рис.6. График зависимости оптической плотности хлороформенного экстракта комплекса ванадия(V) с N-4-метилбензоилфенил-гидроксиламином от концентрации ванадия(V) в водном растворе.

Рис.7. График зависимости оптической плотности хлороформенного экстракта комплекса ванадия(V) с N-п-бромбензоилфенил-гидроксиламином от концентрации ванадия(V).
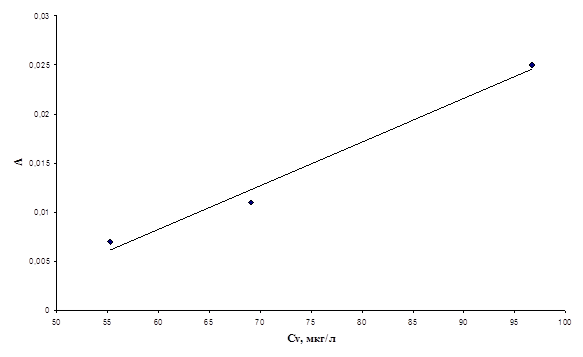
Рис.8. График зависимости оптической плотности хлороформенного экстракта комплекса ванадия(V) с N-п-бромбензоилфенил-гидроксиламином от концентрации ванадия (V).

Рис.9. График зависимости оптической плотности хлороформенного экстракта комплекса ванадия(V) с N-циннамоилфенил-гидроксиламином от концентрации ванадия (V).
По представленным графикам из наклона прямых были рассчитаны коэффициенты экстинкции комплексов ванадия(V) с реагентами. Полученные данные представлены в таблице 3.
Табл.3 Значения коэффициентов экстинкции комплексов ванадия (V) с различными реагентами.
| Реагент | е, л/моль*см |
| N-4-метилбензоилфенилгидроксиламин | |
| N-п-бромбензоилфенилгидроксиламин | |
| N-п-нитробензоилфенилгидроксиламин | |
| N-циннамоилфенилгидроксиламин |
Из представленных данных видно, что наибольшее значение коэффициента экстинкции имеет комплекс ванадия(V) с N-4-метилбензоилфенилгидроксиламином. Таким образом, данный реагент представляет наибольший интерес.
3.6. Построение градуировочного графика методики экстракционно-фотометрического определения ванадия(V) с N-4-метилбензоилфенилгидроксиламином (СОКРАЩЕНИЕ СЮДА И ДАЛЕЕ ПОЛЬЗОВАТЬСЯ ИМ).
Была построена зависимость оптической плотности экстракта ванадия с N-4-метилбензоилфенилгидроксиламином от концентрации ванадия в водных растворах. Для этого была приготовлена серия растворов с содержанием ванадия(V) 4 – 250 мкг/л. Полученные экспериментальные данные приведены в таблице 4.
Табл.4 Значения оптических плотностей хлороформенных экстрактов комплекс ванадий(V) - N-4-метилбензоилфенилгидроксиламин при различных концентрациях ванадия в водном растворе.
| Cv, мкг/л | А±∆А (n=3, P=0.95) |
| 4,15 | 0,0083±0,0014 |
| 5,53 | 0,0127±0,0063 |
| 6.91 | 0,0167±0,0052 |
| 8,29 | 0,0203±0,0080 |
| 11,1 | 0,0223±0,0038 |
| 13,8 | 0,0243±0,0080 |
| 27,6 | 0,0447±0,0080 |
| 69,1 | 0,0907±0,0076 |
| 96,7 | 0,124±0,008 |
| 138,2 | 0,181±0,007 |
| 165,8 | 0,219±0,009 |
| 207,3 | 0,272±0,008 |
| 248,7 | 0,322±0,009 |
На основании данных таблицы 4 был построен градуировочный график зависимости оптической плотности хлороформенных экстрактов от концентрации ванадия(V) в водном растворе (рис.10).

Рис.10. Градуировочный график методики экстракционно-фотометрического опредления ванадия(V) с N-4-метилбензоилфенилгидроксиламином.
Градуировочный график был обсчитан по методу наименьших квадратов. Прямолинейная градуировочная зависимость описывается уравнением:
A = a + b·Cv
Где: a = 0,00648
b = 0,00127
Sa = 0,00119
Sb = 1,27·10-5
При P = 0,95 и n = 3 коэффициент Стьюдента t = 2.2, следовательно:
∆a = 7,3·10-4
∆b = 7,8·10-6
Наклон градуировочного графика соответствует значению коэффициента экстинкции комплекса ванадий - N-4-метилбензоилфенилгидроксиламин в хлороформе и равен 6470.ПОЧЕМУ НЕ СОВПАДАЕТ С НАЙДЕННЫМ РАНЕЕ?
3.7. Экстракционно-фотометрическое определение содержания ванадия(V) в природных водах.
Сравнительное изучение вновь предложенного реагента на ванадий….. и традиционного …. было проведено с использованием проб реальных вод. Содержание ванадия в природных водах чрезвычайно мало и его концентрирование неизбежно. Также большая часть ванадия в природной воде находится в неактивной закомплексованной форме, поэтому его определение возможно лишь после полного кислотного разложения проб с окислением имеющихся в них органических веществ. Выбранная нами методика пробоподготовки включает в себя упаривание анализируемых проб с хлорной кислотой до появления ее паров, т.е. до полного разрушения имеющихся органических веществ.
Стандартная методика пробоподготовки выглядела следующим образом:
1. Фильтрование пробы воды (немногим больше 1 л) через бумажный фильтр с использованием системы колба Бунзена – воронка Бюхнера.
2. Точное измерение объема забираемой пробы воды с помощью мерной колбы на 1 л.
3. Добавление к анализируемой пробе 1 мл хлорной кислоты.
4. Упаривание 1 л воды на электроплитке до появления паров хлорной кислоты.
5. Добавление к упаренной пробе 1 мл фосфорной кислоты для маскирования сопутствующих ванадию элементов.
6. Доведение объема пробы до 25 мл дистиллированной водой.
Вопрос о знаке заряда присутствующих в природных водах форм ванадия(V) может быть разрешен предварительным пропусканием анализируемых проб через ионообменные смолы. В таком случае часть пробы, которая прошла через катионообменную смолу, не будет содержать катионные формы ванадия(V), а только его анионные формы. Часть пробы, которая прошла через анионообменную смолу, не содержит анионные формы ванадия(V), а только его катионные формы. Для соответствующих целей использовали 10 см слои ионообменных смол: катионообменной КУ-2 в H+ форме и анионообменной АМБЕРЛИТ в Cl- форме. Через катионообменную смолу проба пропускалась со скоростью ~ 11,3 мл/мин, а через анионообменную – со скоростью ~ 4,8 мл/мин.
Суммарное содержание ванадия(V) определялось с помощью N-БФГА и N-4-метилбензоилфенилгидроксиламин, а содержание катионных и анионных форм определялось с помощью только N-4-метилбензоилфенилгидроксиламин. Результаты представлены в таблице 5.
Табл.5. Содержание ванадия(V) в образцах анализируемых вод (n=3, P=0.95).
| Проба воды | N-БФГА | N-4-метилбензоилфенилгидроксиламин | ||
| Суммарное содержание ванадия (V), мкг/л | Суммарное содержание ванадия (V), мкг/л | Содержание катионных форм, мкг/л | Содержание анионных форм, мкг/л | |
| Водопровод, Ст.Петергоф | 7,5±1,3 | 7,3±1,5 | 1,7±0,9 | 4,5±0,2 |
| Р. Нарова, пос. Переволок, Лен. обл. | 8,0±1,6 | 7,6±0,9 | 1,8±0,7 | 5,3±0,9 |
| Троицкий ручей, Ст. Петергоф | 4,7±1,4 | 4,6±0,7 | 2,5±0,8 | 2,7±0,6 |
| Пруд, парк Сергиевка, Ст. Петергоф. | 4,5±1,1 | 4,9±1,5 | 1,3±0,6 | 3,0±0,6 |
| Ольгин пруд, Н. Петергоф | 4,1±1,4 | 4,6±0,8 | 0,8±0,4 | 3,4±0,5 |
3.8. Изучение влияние концентрации соляной кислоты на экстракционно-фотометрическое определение ванадия(V).
При экстракционно-фотометрическом определении ванадия(V) затрачивается большой объем соляной кислоты. В связи с этим встает вопрос: возможно ли проведение экстракционно-фотометрического определения ванадия(V) в солянокислой среде меньшей концентрации? Для ответа на этот вопрос экстракция комплексов ванадия(V) с N-БФГА и N-4-метилбензоилфенилгидроксиламином проводилась при различных значениях концентрации соляной кислоты. Результаты этого эксперимента приведены в таблице 6.
Табл.6. Значения оптических плотностей хлороформенных экстрактов комлексов ванадия(V) с N-БФГА и N-4-метилбензоилфенил-гидроксиламином при различных концентрациях соляной кислоты, Cv = 0,138 мг/л.
| CHCl, моль/л | А, комплекс ванадий(V) - N-БФГА | А, комплекс ванадий (V) - N-4-метилбензоилфенилгидроксиламин |
| 0,035 | 0,043 | |
| 0,4 | 0,060 | 0,059 |
| 0,8 | 0,065 | 0,082 |
| 1,2 | 0,102 | 0,118 |
| 1,6 | 0,120 | 0,121 |
| 2,0 | 0,126 | 0,134 |
| 2,4 | 0,152 | 0,174 |
По результатам, представленным в таблице 6, были построены графики зависимости оптической плотности хлороформенных экстрактов комлексов ванадия (V) с N-БФГА и N-4-метилбензоилфенилгидроксиламином от концентрации соляной кислоты. НА ОДНИ ОСИ, ЛИНИИ ПРОВЕСТИ КАК СРЕДНИЕ. УВЕЛИЧИТЬ HCl/ МОЖЕТ ЕЩЕ НЕ ДОСТИГЛИ ПЛАТО…
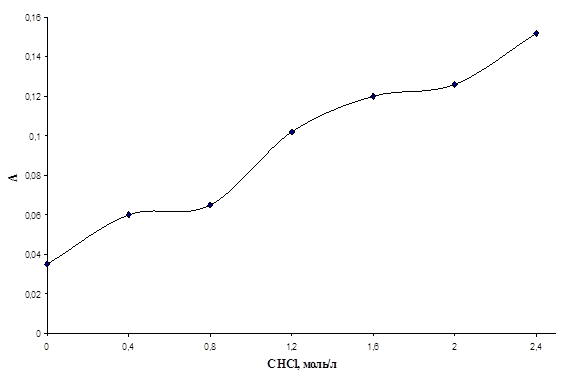
Рис.11. График зависимости оптической плотности хлороформенного экстракта комлекса ванадия(V) с N-БФГА от концентрации соляной кислоты.
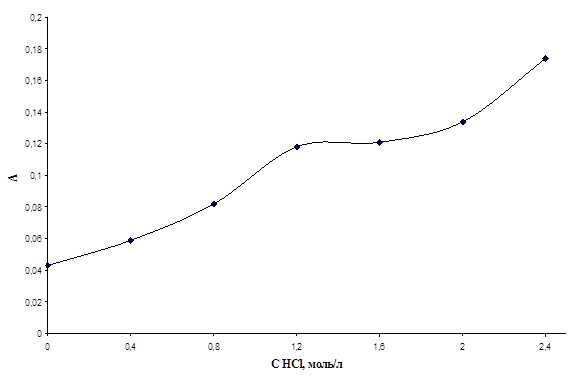
Рис.12. График зависимости оптической плотности хлороформенного экстракта комлекса ванадия(V) с N-4-метилбензоилфенил-гидроксиламином от концентрации соляной кислоты.
Из графиков видно, что концентрация соляной кислоты оказывает значительное влияние на протекание реакции образования комплекса ванадия(V) как с N-БФГА, так и с N-4-метилбензоилфенилгидроксиламином. Таким образом, … (не знаю, как выразить мысль о том, что не стоит уменьшать количество добавляемой кислоты) Вы сначала должны показать, что исп. Кол-во не мало!
Список литературы.
1. Музгин В.Н., Хамзина Л.Б., Золотавин В.Л., Безруков И.Я. Аналитическая химия ванадия, М.: Наука, 1981
2. Сонгина О.А. Редкие металлы, М: Металлургиздат, 1951
3. Рощин А.В. Ванадий и его соединения, М: Медицина, 1968
4. Schiller K., Thilo E. SpektrophotometrischeUntersuchung von Vanadatgleichgewichten in verdunntenwassrigenLosungen. // Z. Enorg. Chem. – 1961. – Bd. 310. – HF 4 – 6. – s. 261 – 285
5. Ивакина А.А., Фотиева А.А. Химия пятивалентного ванадия в водных растворах, Свердловск, Академия наук СССР, Уральский научный центр,1971
6. Бусев А.И., Типцова В.Г., Иванов В.М. Практическое руководство по аналитической химии редких элементов, М: Химия, 1966
7. Поляк Э.А., Городенцева Т.Б. – Тр. Всесоюз. н.-и. ин-та станд. обр. и спектр.этал., 6, 41, 1970
8. Сонгина О.А., Студенская Л.С., Бектурова Г.Б., Маслова П.И., Городенцева Т.Б. – Тр. ВНИИ станд. обр. и спектр.этал., 4, 112, (1968)
9. Кольтгоф И.М., Белчер Р., Стенгер В.А., Матсуяма Дж., Объемный анализ. М.: Госхимиздат, т.3, с. 719, 730, (1961)
10. Хитаров П.И. – Зав. лаб., 4, 491, (1935)
11. RaoG.G., RaoP.K. – Ibid., 14, 33, (1967)
12. ChawlaK.L., TandonJ.P. – Ibid., 6, 332, (1968)
13. ШварценбахГ., ФлашкаГ., Комплексонометрическоетитрование. М.: Химия, 1970
14. Kaimal W.R.M., Shome.C. – Anal. chim. Acta, 27,594, (1962)
15. МариновВ. Химияииндустрия (НРБ), 43, 353, (1971)
16. КусакинаН.П., ЯкимецЕ.М. – Тр. Уральск. Политехн. ин-та, № 121, 91, (1962)
17. SajoJ. – Z. anal. Chem., 188, 168, (1962)
18. ЯцимирскийК.Б. Кинетическиеметодыанализа. М.: Химия, 1967
19. КрейнгольдС.У., ЮжальЕ.М., Покровская И.Е., Иванов Ю.А. Определение ванадия в веществах особой чистоты и природных водах кинетическим методом. // Заводская лаборатория. 1981. 47Т. - №5. – с.17 – 19
20. Степин В.В., Силаева Е.В., Плисс А.М., Курбатова В.И., Федорова Н.Д., Поносов В.И. Анализ черных металлов, сплавов и марганцевых руд. М.: Металлургия, 1971
21. Rao V.P.R., Sarma B.V.S. – Chemist-Analyst, 54, 107, (1965)
22. Singh V.B., Prasad B.N. – J. Sci. Res. Banaras Hindu Univ., 12, 116, (1961-1962)
23. Khalifa H., El-Sirafy A. – Z. anal. Chem., 227, 109, (1967)
24. Khalifa H., Ismail I.A. – Microchim. J., 14, 464, (1969)
25. КрюковаТ.А., СиняковаС.И., АрефьеваТ.В. Полярографическийанализ. М.: Госхимиздат, 1959
26. ЗозуляА.П. Кулонометрический анализ. Л.: Химия, 1968
27. Гончаренко А.С. Электрохимия ванадия и его соединений. М.: Металлургия, 1969
28. АгасянП.К., БасовВ.Н., КостроминА.И.Журнал аналитической химии, с. 1933, (1970)
29. Костромин А.И., Ахметов А.А., Орлова Л.Н. Журнал аналитической химии, 25, 195, (1970)
30. Cole P.C., Eckirt F.M., Williams K.Z. Determination of dissolved and particulate vanadium in sea water by x-ray fluorescence spectrometry. // Anal. Chim. Acta. 1983. – Vol. 153. – p. 61 – 67
31. СимузиТ.,Ксида Ю., Шийо Ю. Определение ванадия в речной воде сочетанием метода соосаждения в атомно-абсорбционной спектрометрии с использованием графитовой кюветы. // БунсэкиКашаку. 1981. – Т.30. - №2. – с. 113 – 117 Рж. Химия. 1981. – 18Г. 199
32. Monien H., Stangel R. ExfamrungenzurBestimmung von Vanadium mittlesatomabsorptoins spectrometric in Kohleofenwichger Extraction ausMeerwasser // Fresenias Z/ Anal. Chem. 1982. – Bd.311. - № 3. – s. 209 – 213
33. Yoshio S., Yokio K., Yokuo S. Determination of vanadium in sea water by graphite furnace atomic absorption spectrometry. // Bunseki Kagaku 1983. – Vol. 32. - № 9. – p. 285 – 291
34. RomanM., Garcia-SanchesF., GomezH.A. – Quim. anal. (purayapl.), 28, 191, (1974)
35. Martin E.L., Bentley K.E. – Ibid., 34, 354, (1962)
36. Золотавин В.Л., Безруков И.Я., Санников Ю.И.Журнал неорганической химии, 6, 584, (1961)
37. Харламов И.П. Спектрофотометрический анализ сплавов. М.: Металлургия, с. 71, 170, (1969)
38. Sarma P.L. – Anal. Chem., 36, 1076, (1964)
39. Долгорев А.В. – В кн.: Химия и химическая технология ванадиевых соединений. Пермь: Кн. Изд-во, с.447, (1974)
40. Марченко З. Фотометрическое определение элементов. М.: Мир, 1971, с.128 – 137
41. R.L. Dutta, S. Lahiry. J.Indian Chem. Soc., 39, 860, (1962)
42. R.L. Dutta, S. Lahiry. J.Indian Chem. Soc., 40, 53, (1963)
43. ШнайдерманС.Я., КлименкоЕ.П., КнязеваЕ.Н., Черная Н.В. Журнал неорганической химии, 14, 1238, (1969)
44. Patrowsky V. – Chem. listy, 49, 854 (1955); Coll. Czech. Chem. Communs, 31, 3392, (1966)
45. Huart A., Chaussabel L., Corgier J., Deron S., Detwiller J., Disant C. – Note CEA, N 1341, 55, (1970)
46. ШнайдерманС.Я., КлименкоЕ.П., Прокопьева Г.П. Журнал неорганической химии, 14, 1552, (1969)
47. Смирнов А.Н. Изучение фталексонов как реагентов для спектрофотометрического определения ванадия. Саратов, 1983
48. Муликовская Е.П. Определения ванадия в природных водах // В кн. Методы анализа минерального сырья. Тр. Всесозн. н.-и. ин-та 1964. Т.117. – с. 79 – 84
49. Новиков Ю.В., Ласточкина К.О., Болдина З.Н. Методы определения вредных веществ в воде водоемов. М.: Медицина 1981. – с. 376
50. Heitner-WirguinC., GanezM. – Talanta, 14, 671, (1967)
51. Калугин А.А., Нипрук О.В., Егорова О.А. Определение микроколичеств ванадия (V) в водных растворах труднорастворимых уранованадатов различных металлов. Нижегородский ГУ им. Н.И. Лобачевского, 1999
52. Janousek J.J. – Coll. Czech. Chem. Communs, 27, 2972, (1962)
53. Otomo M. – Bull. Chem. Soc. Japan, 36, 137, (1963)
54. Тихонов В.Н. Журнал аналитической химии, 21, 1172, (1966)
55. Назаренко В.А., Вещикова Н.А., Новоселова М.М. Журнал аналитической химии, 1984, 39.№12, с. 2151
56. Мамедова АМ., Иванов В.М., Ахмедов С.А. Взаимодействие W(VI) и V(V) с пирогаллоловым красным и бромпирогаллоловым красным в присутствии ПАВ, Вести Московского ун-та сер.2, Химия, 2004. Т.45.№2
57. Попова В.Ф. Спектрофотометрический метод определения ванадия путем сочетания его с капрогидроксамовой кислотой: Автореф. Дисс. Канд,хим.наук / ТашПи. – Ташкент. – 1970. – с. 18
58. Dutta R.L. – J. Indian Chem. Soc., 35, 243 (1958); 36, 285, 339 (1959)
59. Hulcher F.H. – Anal. Chem., 32, 1183, (1960)
60. ПоповаВ.Ф., МаркманА.Л. – Узб. хим. ж., № 4, 18 (1966); Тр. Ташкентск. политехн. ин-та, вып. 64, 3, (1970)
61. ЖаровскийФ.Г., ПилипенкоА.Т. Украинский химический журнал, 25, 230, (1964)
62. Алимарин И.П., Судаков Ф.П., Головкин Б.Г. – Усп. хим., 31, 989 (1962)
63. Жаровский Ф.Г., Пилипенко А.Т. Украинский химический журнал, 25, вып. 2, 230, (1959)
64. Чмутова М.К., Петрухин О.М., Золотов Ю.А. Журнал аналитической химии, 18, 588, (1963)
65. ТомиокоХидэо «БунсэкиКагаку» JapanAnalyst 12, 3, 271, (1963); РЖХ 21, 21 Г85,(1963); Repts. Covt. Chem. Industr. Res. // Tokyo 58, 387,(1963); РЖХ, 13, 13 Г78, (1964)
66. Пограничная Р.М., Нерубащенко В.В., Цевина А.В. Экстракция ванадия в виде комплекса с 4-(2-пиридилазо)-резорцином. // Ж. аналит. химии, 1972. – Т.24. Вып.9, с. 1845 – 1847
67. Алимарин И.П., ЦзеЮнь-сян. Вестник Московского университета, серия химия, 2, 53, (1960)
68. Gupta V.K., Tandon S.G. – Anal. chim. acta, 66, 39 (1973)
69. Tandon S.G., Bhattacharya S.C. – J. Indian Chem. Soc., 47, 583 (1970)
70. Tandon S.G., Bhattacharya S.C. – Anal. Chem., 33, 1267 (1961); 36, 1378 (1964)
71. Agrawal Y.K. – Ibid., 7, 729 (1974)
72. ПилипенкоА.Т., ШпакЭ.А., РубанП.П. – Украинскийхимическийжурнал, 29, 1209 (1963)
73. Abbasi S.A. – Anal. Lett., 9, 113 (1976)
74. Majumdar A.K., Das G. – Ibid., 31, 147 (1964)
75. Гусакова Н.Н., Еременко С.Н., Муштакова С.П., Фрумина Н.С.– Журнал аналитической химии, 30, 721 (1975)
Дата публикования: 2014-11-18; Прочитано: 548 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
