 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Обзор литературы
|
|
2.1. Ванадий в окружающей среде.
Многообразие ионных форм и степеней окисления ванадия определяют его высокую подвижность в земной коре и значительную рассеянность в природе. Ванадий редко образует крупные скопления руд, но легко концентрируется в почвах [1]. Обладая способностью к рассеиванию, он часто встречается в качестве примеси в различных минералах и горных породах [2]. Миграция, рассеивание и концентрирование ванадия в биосфере осуществляется путем извлечения его живыми организмами из воды, растительной и животной пищи, из различных пород и путем высвобождения его в результате разложения и минерализации органического вещества [3]. Содержание ванадия в почве оценивается в 10−2 %, в растениях - 10−4 %, в организмах млекопитающих и человека - 10−5 %. Ванадий в живых организмах играет роль катализатора окислительно-восстановительных процессов. Но многие его соединения являются ядами. Наибольшей токсичностью обладают соединения ванадия со степенью окисления +5. Для человека и высших животных механизм токсичности соединений ванадия недостаточно изучен. В тоже время известно, что ванадий является стимулятором роста многих культурных растений и сельскохозяйственных животных. Концентрация микроэлемента ванадия в природных водах составляет 0,01 – 20 мкг/л (в незагрязненных пресных водах). В некоторых реках и озерах обнаружена более высокая концентрация ванадия. В земной коре ванадия содержится 1,5∙10−2% по массе [4].
Химия природных соединений ванадия чрезвычайно разнообразна и порой настолько сложна, что до сих пор нет единого мнения о природе и условиях существования отдельных форм этого элемента. Важной особенностью пятивалентного ванадия является то, что его состояние в водных растворах зависит от рН среды. В сильно щелочных растворах он существует в виде моноядерной частицы – ортованадат-иона; с уменьшением концентрации щелочи возникают полиядерные анионные частицы. В достаточно кислых растворах ванадий (V) существует в виде моноядерного оксокатиона [5]. Ионы ванадия (V) в сильнокислых средах (например, 3М H2SO4) проявляют сильные окислительные свойства. Растворы ванадата применяются для титриметрического определения многих восстановителей. При понижении концентрации кислоты окислительные свойства пятивалентного ванадия ослабевают. В слабокислых растворах ионы ванадата уже не окисляют многих восстановителей.
Соли ванадила (VO2+) окисляются в умереннокислых растворах сильными окислителями. Так, они количественно окисляются раствором перманганата в среде 5%-ной H2SO4 или раствором бромата калия в разбавленных солянокислых растворах, содержащих соли аммония. При повышении рН тенденция к окислению V4+ усиливается. В щелочной среде он окисляется даже кислородом воздуха [6].
Заряд катионов ванадия в растворе не превышает трех; в степенях окисления 4+ и 5+ он образует устойчивые оксикатионы VO2+, VO23+ и VO3+. Ванадий во всех степенях окисления образует комплексные соединения. По способности преимущественно координироваться в комплексных соединениях с донорными атомам лигандов N, O и S катионы ванадия(IV) и ванадия(V) относятся к ряду металлов, которые образуют с кислородом более прочную связь, чем с азотом, а катионы ванадия(III) – к ряду металлов, у которых связь с азотом прочнее, чем с кислородом. По такому типу и протекает комплексообразование ванадия с природными лигандами типа фульво- и гуминовых кислот [1]. Далее абзацы переставлялись и нумерацию ссылок надо пересмотреть.
2.2. Методы определения ванадия.
2.2.1. Титриметрические методы.
Титриметрическое определение ванадия основано на его реакциях с окислителями (восстановителями) и комплексонами. Наибольшее распространение получили оксидиметрические методы.
Оксидиметрическое титрование.
Ванадий в водных растворах может быть получен в различных степенях окисления (II, III, IV, V), поэтому в качестве титрантов применяют как окислители, так и восстановители.
Титрование восстановителями. Ванадий(V) является сильным окислителем и в кислых растворах взаимодействует с большинством восстановителей, переходя в ванадий(IV), поэтому для титрования рекомендованы растворы солей железа(II), олова(II), титана(III), аскорбиновой кислоты и др. Для получения точных результатов ванадий предварительно полностью переводят в пятивалентное состояние действием различных окислителей. Для этой цели рекомендованы перманганат калия, хлорная кислота, озон и бромат калия.
Широко распространенным и наиболее точным методом определения ванадия является титрование его раствором соли железа(II)[7]. В кислой среде железо(II) восстанавливает ванадий(V) до ванадия(IV). Методом амперометрического титрования показано, что эта реакция в 1-4М H2SO4 протекает стехиометрично и не зависит от форм существования ионов ванадия(V) в растворе [8]. Для определения точки эквивалентности в зависимости от кислотности среды используют ox-red индикаторы, например фенилантраниловую кислоту.
Титрование окислителями. В водных растворах ванадий(V) предварительно восстанавливается до низших степеней окисления (II, III, IV) под действием различных восстановителей и далее титруют растворами окислителей. Чаще всего используют восстановление ванадия(V) до ванадия(IV) сернистым ангидридом, сульфитом или бисульфитом натрия.
· Перманганатометрия. Соли ванадия(IV) окисляются перманганатом калия с заметной скоростью только в слабокислой среде (~0,05 М H2SO4) при нагревании до 50 – 80 0С. При меньшей кислотности раствора (pH 2) ванадий(IV) начинает окисляться кислородом воздуха, а при увеличении концентрации кислоты реакция замедляется [9]. Титрование обычно проводят без индикатора до появления слабо-розовой окраски раствора, устойчивой в течение 1 – 2 мин.
· Бихроматометрия. В сернокислой среде бихромат калия взаимодействует только с ванадием(III), но в присутствии следов марганца(II) [10], а также в 3 – 12 М растворе фосфорной кислоты [11] он может окислять и ванадий(IV). Определение ванадия(III) рекомендуют проводить в присутствии катализаторов: ионов меди(II) в сернокислой среде и железа(III) в фосфорнокислой среде. В качестве индикатора используют фенилантраниловую кислоту или дифениламин [12].
· Иодометрия. В кислых растворах ванадий(V) восстанавливается иодидом калия до ванадия(IV). В щелочных растворах иод окисляет ванадий(IV) до ванадия(V). На стехиометричность обеих реакций существенное влияние оказывают условия их протекания, поэтому разработаны лишь косвенные методы иодометрического определения ванадия.
Комплексонометрическое титрование.
Ванадий(V) в водных растворах существует в виде сложных ионов, поэтому его взаимодействие с комплексоном III замедленно и в большой степени зависит от рН. Более распространены методы титрования ванадия(IV), который взаимодействует с комплексоном III в широком интервале рН [13]. Для восстановления ванадия(V) используют сульфит натрия или сернистую кислоту [14], аскорбиновую кислоту и гидроксиламин [15]. Титрование ванадия(IV) раствором комплексона III можно проводить в присутствии различных индикаторов. При рН 3 – 3,5 используют N-бензоил-N-фенилгидроксиламин (N-БФГА) [6,14].
Ванадий также может быть надежно определен методами обратного титрования. К анализируемому раствору приливают комплексон III и оттитровывают непрореагировавший избыток его растворами солей различных металлов. Ванадий(V) определяют при рН 3,5 – 6. Избыток комплексона III титруют раствором соли цинка в присутствии индикатора дифенилкарбазона [16] или растворами солей цинка, свинца или кадмия с пирокатехиновым фиолетовым [17].
Комплексонометрические методы не имеют преимуществ перед методами оксидиметрического титрования. Их используют при анализе ванадатов или сплавов на основе ванадия в том случае, если другие компоненты определяют также комплексонометрически.
2.2.2. Кинетические методы.
Ванадий оказывает сильное каталитическое действие на многие окислительно-восстановительные реакции. Скорость реакций в большинстве случаев прямо пропорциональна концентрации ванадия. Каталитические реакции высокочувствительны. Они позволяют определять до 10-4 – 10-5 мг/л ванадия. В ряде случаев можно значительно повысить чувствительность реакций введением очень небольших количеств активаторов (оксикислот, о-дифенолов, 8-оксихинолина и др.) [18]. Ванадий в минеральной, сточной, речной воде и рассолах определяют [19] кинетическим методом по индикаторной реакции окисления 1,2-фенилендиаминаброматом калия, активатор - тайрон, предел обнаружения – 0,05-0,4 мкг/л в зависимости от состава воды.
Соединения ванадия ускоряют также реакцию окисления анилина хлоратом калия при рН 6.5 – 7.5. Катализирующее действие ионов ванадия усиливается в присутствии 8-оксихинолина [6].
2.2.3. Электрохимические методы.
Потенциометрическое титрование.
Метод основан на резком изменении потенциала индикаторного электрода вблизи точки эквивалентности при титровании. В методе используют реакции окисления – восстановления, комплексообразования и осаждения. С использованием потенциометрической регистрации ванадий(V) титруют растворами железа(II) в кислой среде, глицерина в щелочной среде [20], сульфата гидразина в присутствии катализатора OsO4 , тиосульфата натрия в присутствии катализатора ионов Cu2+ [21], а также растворами молибдена(III), хрома(II), титана(III) и аскорбиновой кислоты [22]. Методом комплексонометрического титрования с потенциометрической регистрацией определяют ванадий(IV) обратным титрованием раствором Hg2+ при рН 8 (уротропиновый буфер) [23]. Осадительное аргентометрическое титрование ванадия(V) до ортованадата серебра проводят при рН 11.5, используя серебряный индикаторный электрод [24].
Полярографические методы.
Полярографическое поведение пятивалентного ванадия сильно зависит от рН среды. В кислых растворах он дает две волны, первая соответствует восстановлению ионов Hg22+, получаемых в результате окисления металлической ртути ионами пятивалентного ванадия, а вторая – восстановлению четырехвалентного ванадия до двухвалентного (E1/2=-0.83В отн. НКЭ) [25]. На последнюю волну дополнительно накладывается волна водорода, и поэтому количественное определение ванадия затруднено.
Амперометрическое титрование.
Для косвенного амперометрического определения ванадия применяют реакции окисления-восстановления, осаждения или комплексообразования. За процессом титрования следят по изменению тока восстановления или окисления одного из участников реакций. В качестве индикаторных электродов используют ртутный капельный либо платиновый микроэлектрод. Определение точки эквивалентности довольно просто и надежно, а методически амперометрическое титрование не отличается от обычных титрометрических методов.[1]
Кулонометрические методы.
Определение ванадия методом потенциостатической кулонометрии применяют крайне редко из-за необходимости отделения его от многих мешающих элементов и длительности подготовки проб при анализе сложных объектов [26]. С другой стороны ванадий можно успешно определить титрованием окислителями или восстановителями, генерированными в электролитической ячейке (т.е. методом кулонометрического титрования). Точку эквивалентности устанавливают спектрофотометрическим, потенциометрическим или амперометрическим методом, а также визуально – по изменению окраски индикаторов. Содержание ванадия находят по закону Фарадея, пересчитывая количество электричества, пошедшего на получение титранта, необходимого для окисления (восстановления) ванадия.
Микрограммовые количества ванадия титруют электрогенерируемыми ионами Fe(II) с амперометрическим установлением точки эквивалентности [27]. Наряду с ионами Fe(II) в качестве титрантов-восстановителей применяют ионы Mo(V), W(V), Ti(III), Cu(I) и V(III) [28], а в качестве титрантов-окислителей – Cr(VI), Fe(III), хинон [29].
2.2.4. Методы атомной спектроскопии.
Методы эмиссионной спектроскопии.
В низкотемпературных пламенах определение ванадия возможно лишь по измерению интенсивности молекулярных полос моноокиси ванадия (VO) с максимумами при 528,0; 550,0; 573,7 и 578,0 нм. Это обусловлено высокой энергией диссоциацией VO, равной 5,5 эв. Использование высокотемпера-турных пламен таких, как кислород–ацетилен и закись азота– ацетилен, дает возможность определять до 3 мкг/мл ванадия по атомным линиям VI 318,5 и VI 437,9 нм при существенном уменьшений различного рода влияний.
После экстракционного выделения (концентрирования) ванадия в виде оксихинолината и распыления экстракта непосредственно в водородно-кислородном пламени можно определить до 50 мкг/мл ванадия по молекулярной полосе 528,0 нм. Повышение восстановительных свойств пламени (за счет применения органических растворителей, в частности, этанола) снижает предел обнаружения ванадия до 2 – 8 мкг/мл [1].
Предложен рентгенофлуоресцентный метод определения ванадия в морской воде [30] (предел обнаружения 0,02 мкг/л) с предварительным соосаждением ванадия с пирролидандитиокарбаматом кобальта(III).
Методы атомно-абсорбционной спектроскопии.
Собственной чувствительности атомно-абсорбционного метода определения ванадия недостаточно для его непосредственного определения в природных водах. Поэтому использование операций концентрирования представляется неизбежным. Опробованы [31] различные методы концентрирования ванадия из морской воды перед ААС определением: анионообменная экстракция, метод хелатного обмена, соосаждение с гидратированной TiO2. Лучшим оказался метод соосаждения. Исследована [32] возможность определения ванадия в морской воде методом непламенной атомно-абсорбционной спектроскопии после предварительного экстракционного концентрирования с помощью следующих реагентов: ПАР+ хлорид тетрафениларсония; ПАР+хлорид тетрадецилдиметилбензил аммония; N-бензоилфенилгидроксиамина, 5,7-дихлор-8-гидроксиламина, тетраметилендитиокарбамата натрия. Для ААС определения ванадия на уровне мкг/л лучшими реагентами оказались ПАР с хлоридом тетрадецилдиметилбензиламмония или тетраметилендитиокарбамат натрия. Для определения ванадия в морской воде на уровне мкг/л разработана методика [33] экстракционного концентрирования в виде роданидного комплекса триоктиламмония; реэкстракты анализируют ААС с графитовой кюветой.
2.2.5. Методы молекулярной спектроскопии.
Люминесцентные методы.
Известно всего несколько люминесцентных реакций с участием ванадия. Ванадий дает желтую флуоресценцию с церулеином после восстановления его цинком до V(II) и добавления спирта. Метод позволяет обнаружить до 16 мкг/мл ванадия. С резорцином ванадий дает в 10 М H2SO4 или конц. Н3PO4 красную флуоресценцию, которая исчезает через 5 мин. Предел обнаружения ванадия составляет 2,5 мкг/мл. Описан метод люминесцентного определения 0,1 – 0,8 мкг ванадия(V) в водно-спиртовом растворе с 1,4-диамино-5-нитроантрахиноном [34].
Фотометрические методы.
Для определения ванадия применяют методы, основанные на измерении поглощения электромагнитного излучениями растворами непосредственно ионов ванадия (V), ванадия (IV), ванадия (III), так и окрашенными продуктами взаимодействия ванадия с неорганическими и органическими реагентами.
Методы определения, основанные на измерении оптической плотности растворов, содержащих ионы ванадия (V), ванадия (IV), ванадия (III), малочувствительны, но позволяют быстро определять ванадий в простых по составу объектах: растворах, окислах, ванадатах [1]. Ионы ванадия в степенях окисления II, III, IV и V различно окрашены и имеют характерные абсорбционные спектры [35]. Ванадий (V) в растворе в зависимости от его концентрации и кислотности среды может находиться в различных ионных состояниях, которые характеризуются определенными полосами поглощения [36]. Однако сложные ионные равновесия затрудняют использование абсорбционных спектров ванадия (V). Для его определения рекомендуют только две полосы поглощения с максимумами при 330 нм в конц. H2SO4 и при 270 нм в 1М NaOH. Молярные коэффициенты погашения соответственно равны 4,6·103 и 8,4·103 [37].
Определению мешают многие элементы. Окрашенные ионы Co(II), Ni(II), Cu(II) и др. предварительно осаждают в виде гидроокисей. Хром отделяют в виде оксихинолината или хромата свинца [38] большие количества железа(III) отделяют электролизом на ртутном катоде. Титан маскируют фторид-ионами. Определению ванадия при 270 нм в щелочной среде не мешают W, Ti, Zr, а также равные количества Re, Mo и Nb [37]. Для повышения избирательности определения ванадия в кислой среде оптические плотности растворов измеряют при 450 - 480 нм.
Определение ванадия по образованию окрашенных соединений с неорганическими реагентами.
Перекись водорода взаимодействует с ванадием в кислой среде с образованием устойчивого комплексного иона [V(O2)]3+ красно-оранжевого цвета [39]. Его молярный коэффициент погашения при 460 нм равен ~200 [40]. Перекисное соединение образуется в широком интервале концентраций кислоты (0.3 – 3 М H2SO4) и при содержании перекиси водорода 0,03 – 0,09 % [39]. Допустима замена серной кислоты на соляную или азотную. Окраска растворов устойчива в течение 1 – 2 суток.
Возможно определение ванадия по окраске фосфорновольфрамо-ванадиевой кислоты. Это гетерополисоединение (е400нм = 1400) образуется при нагревании соединений ванадия в растворе минеральной кислоты (до 2.4 М) в присутствии 0.5 М фосфорной кислоты и 0.025 М вольфрамата натрия..
Определение ванадия по образованию окрашенных соединений с органическими реагентами.
Вопрос о состоянии ионов ванадия(V) при образовании комплексных соединений с органическими лигандами является чрезвычайно сложным и по большей части не выясненным. В диапазоне рН 2ч5 ванадий(V) может входить в состав комплексов либо в форме катионов VO3+, VO(OH)2+, VO2+, либо в форме анионов V14O114−, V6O174−. Поэтому найденные при изучении комплексообразования соотношения металл-лиганд и константы устойчивости не объясняют химизма процесса и носят условный характер. Это еще более справедливо, если речь идет об экстракции комплексных соединений ванадия с органическими лигандами, поскольку в этом случае дополнительным фактором, усложнившим протекание процесса, является наличие гетерогенного равновесия между двумя несмешивающимися фазами. Наличие катионных форм ванадия(V) в растворе подтверждено в работах по его экстракции трибутилфосфатом (ТБФ) из солянокислых растворов в виде соединений HVO2Cl2∙2ТБФ, VOCl3∙ТБФ [41]. Существование катионных форм ванадия в водных растворах минеральных и органических кислот и их солей было также показано методом электрофореза на бумаге [42].
Ванадий(V) образует несколько окрашенных комплексов с пирокатехином (о-диоксибензолом) [43]. Комплекс состава 1:1 розового цвета образуется при рН 1 – 3 за счет вытеснения водорода одной спиртовой группы.

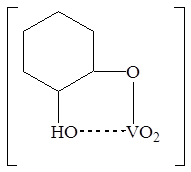
(какая формула верная?)
В интервале рН 3 – 4,7 и 4,7 – 7,0 устойчивы комплексы состава 1:1 и 1:2 соответственно. Для последнего комплекса е590нм = 6800 [44]. Определению не мешают Ce, U, La, As, Pb, Sn, Th, Zr, Cd, Zn (20%), Sb (<10%), Ga (<10%), а также щелочные и щелочно-земельные металлы. Мешают окрашенные ионы Cu(II), Ni(II), Co(II), Cr(III) и ионы, взаимодействующие с реагентом: Fe(III), Al(III), Ti(IV), W(VI), Mo(VI), Nb(V), Bi(III). Большие количества мешающих элементов отделяют в виде гидроокисей или хроматографически [45]. Менее чем 100-кратные количества Fe, Co, Ni, Cr, Mo, W и Cu маскируют аскорбиновой кислотой, цитрат- и цианид-ионами и комплексоном III, 104-кратные количества алюминия – фторид-ионами [44]. Измерение оптической плотности при 800 нм полностью исключает влияние Nb, W, Ti, Bi, образующих желтые комплексы с реагентом.
Интенсивно окрашенные соединения образуются также с другими ортофенолами и 2-гидроксибензойными кислотами [43]. Комплексообразование в этих системах в наибольшей степени протекает в слабокислых и нейтральных средах. Предполагается, что в системе образуются устойчивые хелатные соединения за счет диссоциации гидроксо-групп реагентов. 3,4-диоксибензойная кислота [46] также образует синие комплексы состава 1:1 и 1:2 анионного характера.

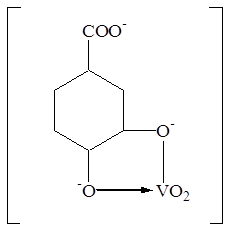
(какая формула верная?)
Образование окрашенного в синий цвет тройного комплекса ванадий(V)-трибромпирогаллол(ТБП)-дифенилгуанидин(ДФГ) состава 1:2:1 в смеси хлороформа и изоамилового спирта (1:2) лежит в основе методики экстракционно-фотометрического определения ванадия. Экстракт имеет максимум светопоглощения при 600 – 650 нм. Определению не мешают ионы Ni, Mn, Cu, Cr, Al, а в присутствии также Fe(III) и Mo маскируют тиогликолевой кислотой, W - тартратом, Zr - фторидом [6].
8-оксихинолин (о-оксихинолин, оксин) образует с ванадием (IV) и ванадием (V) окрашенные в малиновый цвет комплексные соединения, хорошо экстрагирующиеся из слабокислых растворов различными органическими растворителями. Окраска комплекса развивается быстро и устойчива во времени (7 дней и больше) [47]. Помимо ванадия окрашенные комплексы с оксихинолином в этих же условиях дают железо, алюминий, медь, которые также экстрагируются хлороформом из слабо кислого раствора. Отделение ванадия от этих элементов осуществляется реэкстракцией ванадия из органической фазы содовым раствором при рН=9.4 [48]. Ванадий при этом переходит в содовый раствор, а железо, медь и большая часть алюминия остаются в хлороформе. Частично переходящий в щелочной реэкстракт алюминий дополнительно комплексуется малоновой кислотой, раствор доводится до рН=4.5 и ванадий вновь экстрагируется хлороформом. Методика экстракционно-фотометрического определения ванадия с оксихинолином позволяет определить ванадий вплоть до содержаний 1 мкг/л в присутствии 0.5 мг алюминия, висмута, кобальта, хрома, меди, железа, марганца, молибдена, никеля, олова, титана и урана, 0,1 мг вольфрама и 5 мг цинка [49].
Исследовано взаимодействие ванадия с 5,7-дибром- и 5,7-дииод-производным 8-оксихинолина [50]. Образуемые комплексные соединения экстрагируют высокомолекулярными спиртами. Молярные коэффициенты погашения равны (6 – 7)·103. Основным мешающим элементом является железо (III), малые количества которого могут быть замаскированы ионами PO43- и F-.
Фталексоны – красители трифенилметанового ряда, включающие в свой состав группы – CH2N(CH2COOH)2 в орто-положении к карбокси- группе. В кислой среде они взаимодействуют с ванадием (V) с образованием интенсивно окрашенных хелатных соединений различного состава (табл. 1).
Таблица 1. Определение ванадия(V) с фталексонами.
| Реагент | рН | Состав комплекса V:R | лmax, нм | е·10-3 | вуст | Интервал определяемых содержаний V, мг/л | |
| комплекса | R | ||||||
| Ксиленоловый оранжевый | 2:1 1:1 1:2 | 20,0 13,0 | 0,1 – 4,5 | ||||
| Фталексон S | 1:1 | 21,0 | 4.7·105 | 0,25 – 1,25 | |||
| Тимол- фталексон | 2:1 | 25,3 | 4.2·1011 | 1 – 3,5 | |||
| Крезол- фталексон | 1:1 | 6,0 | 5,0 - 20 | ||||
| Метил- тимоловый синий | 3 – 4 5 - 7 | 1:2 1:1 | 19,0 9,8 | 2.3·1012 1.6·106 | 0,15 – 1,5 |
Ксиленоловый оранжевый (КО; 3,3′-бис(N,N'-ди(карбоксиметил)-аминометил)-о-крезолсульфофталеин) – наиболее перспективный реагент для определения ванадия. Высокий молярный коэффициент светопоглощения красителя сочетается с достаточной контрастностью реакции с ванадием (V) и доступностью реагента. В интервале рН = 3ч5 КО преимущественно находится в форме Н3RO33-, которая характеризуется максимумом поглощения при длине волны 430 нм. При рН > 5 вследствие частичного перехода реагента в форму Н2RO43- появляется второй максимум поглощения при 580 нм [51]. При избытке реагента и оптимальном значении рН 3 – 5 окраска комплекса КО с ванадием развивается через 30 с и устойчива более суток. Определению мешают все элементы, взаимодействующие с реагентом в этих условиях, а также дающие окрашенные ионы в растворах (Fe(III), Al, Cu, Zn, Cd, Ga, Bi(III), Zr, Th, Ti(IV), Ni, Co, Mn, Sc(III)). Их предварительно отделяют от ванадия различными способами. Описан, например, метод ионообменного разделения. Выбор маскирующих средств ограничен, так как тартрат-, цитрат-ионы, а также перекись водорода и комплексон III мешают определению ванадия [52]. В качестве маскирующих реагентов рекомендованы фторид калия и комплексон IV (1,2-диаминциклогексан-N,N,N’,N’-тетрауксусная кислота) [53]. В их присутствии окраска развивается медленно (через 10 мин.) и необходим достаточный избыток реактива.
Для определения ванадия(V) рекомендован также метилтимоловый синий. Окрашенное соединение с ванадием образуется при рН 3-4 и при достаточном избытке реагента. Оптическую плотность раствора измеряют при 580 нм. Мешают многие элементы. Но выбор маскирующих средств шире, чем при использовании ксиленолового оранжевого. Определению не мешает 20-кратный избыток фтор-, тартрат_, пирофосфат-ионов [54]. Основную массу мешающих элементов отделяют при вскрытии образцов щелочами.
Большой аналитический интерес представляет комплексообразование ванадия с пирогаллоловым красным (ПК) и бромпирогаллоловым красным (БПК). Взаимодействие ванадия(V) с ПК и БПК без третьего компонента не представляет аналитического интереса для фотометрического определения [55]. В качестве третьего компонента могут выступать катионные поверхностно-активные вещества (ПАВ) или амины, сдвигающие реакцию комплексообразования в кислую область и увеличивающие ее контрастность и чувствительность. Ванадий(V) реагирует с ПК и БПК в присутствии ПАВ, образуя комплексы при рН 1,5–3,8 и 1,3–2,2 соответственно. С ПК в присутствии цетилпиридиния (ЦП) ванадий образует комплекс с максимумом при 575 нм, а с БПК в присутствии ЦП – при 610 нм, при этом контрастность составляет от 100 до 170 нм для комплексов разного состава [56].
Определение ванадия с N-БФГА и родственными реагентами.
Экстракционно-фотометрический метод определения ванадия (V) с использованием N-бензоил-N-фенилгидроксиламина получил наибольшее распространение среди методов, основанных на цветных реакциях ванадия с различными реагентами.
Катионы ванадия(V) преимущественно координируются в комплексных соединениях с донорными атомами лигандами N, O, S, но они относятся к ряду металлов, которые образуют с кислородом более прочную связь, чем с азотом. С этих позиций для аналитической химии ванадия(V) интерес представляют реагенты, в молекулах которых содержаться как те, так и другие донорные атомы. Среди органических реагентов давно находят широкое применение производные фенилгидраксиламина и, в первую очередь, купферрона (аммонийная соль N-нитрозофенилгидроксиламина) [57]:

Купферронаты металлов в аналитической химии применяют для различных целей и, главным образом, для разделения ионов и концентрирования следовых количеств веществ в сочетании с экстракцией их органическими растворителями. Как аналитический реагент купферрон обладает рядом недостатков: неустойчив к воздействию света и тепла, легко окисляется кислородом воздуха, при осаждении из горячих растворов претерпевает разложение и осмоление. Купферронаты элементов нельзя использовать в качестве весовой формы.
Значительное внимание в литературе уделено изучению взаимодействия ванадия(V) с гидроксамовыми кислотами (производными гидроксиламина с одним органическим радикалом), приводящему к образованию интенсивно окрашенных соединений. В работах [41,42] синтезировали многочисленные комплексы ванадия(V) с различными замещенными гидроксамовыми кислотами. Было найдено [41], что бензгидроксамовая кислота C7H6NO2 в водной среде при рН 3 – 4 реагирует с метаванадатом аммония с образованием нерастворимого в воде комплекса темно-фиолетового цвета. На основании химического анализа ему приписана формула [VO(OH)(C7H6NO2)2].формула Бенз-, салицил- и никотингидроксамовые кислоты образуют соединения, растворимые в водно-спиртовых растворах. Остальные дают осадки, растворимые в высокомолекулярных спиртах, кетонах, альдегидах и эфирах. Для фотометрического определения используют водно-спиртовые растворы и экстракты хелатов. Экстрагируемость комплексных соединений зависит от кислотности среды, природы растворителя, а также характера органического радикала [58]. Реагенты малоизбирательны. При различных условиях с ними образуют комплексные соединения ионы многих элементов.
Чаще всего для определения ванадия применяют бензгидроксамовую кислоту, которая в слабокислой среде образует с ванадием (V) окрашенный осадок, растворимый в водно-спиртовом растворе. Окраска раствора устойчива в течение дня [40]. Определению мешают Fe(III), Ti(IV), Mo(VI), Nb(V), Hg(II), Co(II). Железо удаляют электролизом или предварительно экстрагируют совместно с титаном в виде бензгидроксамата при рН 8,5 бутанолом [59].
Большинство из синтезированных в последнее время гидроксамовых кислот не имеют особых преимуществ перед бензгидроксамовой, за исключением капро- и метоксибензтиогидроксамовой, которые образуют соединения с ванадием в более кислых средах (0,15 – 0,4 М H2SO4 и 6 M HCl соответственно) [60]. Это существенно снижает число мешающих элементов.
Производные гидроксиламина с двумя органическими радикалами (двузамещенные гидроксамовые кислоты) – высоко избирательные реагенты на ванадий (V). Наиболее изучен и широко используется N-бензоил-N-фенилгидроксиламин (N-бензоил-N-фенилгидроксамовая кислота) [40].
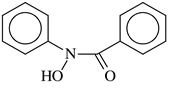
N-бензоил-N-фенилгидроксиламин (БФГА) – бесцветное кристаллическое вещество с Тпл 121 – 122 оС. БФГА плохо растворим в воде, умеренно – в этаноле, бензоле и диэтиловом эфире. Значительно устойчивее к действию окислителей и света, чем купферрон. БФГА взаимодействует с ванадием(V) в кислой среде (9 М – pH 6) с образованием в водных растворах окрашенных хелатных соединений состава (C13H10O2N)2·VO2H, (C13H10O2N)2·VO2CH3 и (C13H10O2N)2*VO2H·HCl. В хлороформе комплекс имеет состав V2O3(C13H10O2N)4 [61]. Подобные комплексы образуют и салицилальдоксим, ацетилацетон, бензоилацетон, изохинолин, гидразид и салицилизен-1,3-диаминопропан [5].
Образующийся комплекс ванадий-N-БФГА можно экстрагировать хлороформом при рН 5,1 – 6,0. Это дает возможность применять реагент для экстракционного разделения компонентов раствора сложного состава и, что особенно важно, для экстракционно-фотометрического определения следов веществ. При исследовании пригодности различных растворителей для экстракции комплекса ванадия с БФГА был получен следующий ряд: бутанол > пентанол > хлороформ > амилацетат > бутилацетат > бензол > гексанол > толуол > метилизобутилкетон > четыреххлористый углерод. Для работы рекомендован хлороформ [62]. Молярный коэффициент погашения хлороформенного раствора равен 3700, максимум полосы поглощения - 445 нм.
Наибольшая избирательность определения ванадия достигается, если проводить экстракцию хлороформом из очень кислых растворов (9-11М по H2SO4 или 3-9 М по HCl) при 10-кратном избытке реагента [40]. При этом экстрагируется пурпурно-красное соединение с широкой полосой поглощения (490-630 нм) и более высоким молярным коэффициентом погашения (е = 4500 - 5100). Найдено, что в этом соединении отношение ванадия к N-БФГА равно 1:2 [40,62]. В зависимости от кислотности раствора имеет место образование различных комплексов ванадия(V) с N-БФГА: в растворах < 0.1М по HCl – оранжево-красного цвета, > 2М по HCl – фиолетового цвета. В 0.1 - 2 М солянокислых растворах существует смесь двух комплексов, имеющая аметистовую окраску [63].
Из сернокислых растворов соединение ванадия(V) с N-БФГА тоже экстрагируется, но окраска хлороформенного слоя приобретает оранжево-желтый цвет (л =530 нм). При подкислении раствора соляной кислотой и повторном встряхивании с хлороформом оранжево-желтая окраска экстракта переходит в пурпурную. Экстракции соединения ванадия(V) с N-БФГА из солянокислых сред отдается предпочтение, так как интенсивность светопоглощения экстракта по сравнению с другими средами является максимальной. Однако экстракты, получаемые из солянокислых растворов, обладают несколько меньшей устойчивостью. Было показано, что это объясняется восстановлением ванадия(V) слабым восстановителем N-БФГА, протекающим в солянокислых растворах [64]. В этих условиях ванадий, восстанавливаясь до степени окисления 4+, не взаимодействует с реагентом и не экстрагируется хлороформом. По сравнению с солянокислыми растворами экстракция соединения из сернокислых обеспечивает большую устойчивость окраски системы и соответственно большую воспроизводимость получаемых результатов [65]. Чувствительность определения в сернокислых растворах несколько ниже, чем в солянокислых средах, но может быть повышена использованием в качестве растворителя смеси этилового спирта и хлороформа (2:8). Экстракт имеет максимум светопоглощения при л = 440 нм. Железо, титан, молибден(VI) и вольфрам(VI) маскируются с помощью фосфорной кислоты. Экстракция соединения ванадия с N-БФГА из сернокислых растворов высокой кислотности перспективна с той точки зрения, что разложение ванадийсодержащих сплавов и объектов минерального сырья чаще всего производят с помощью серной кислоты.
Экстракция бензоилфенилгидроксиламинатов представляет особый интерес при определении следовых содержаний ванадия. Имеется ряд работ [66] по определению ничтожно малых количеств ванадия с помощью N-БФГА. Закон Бера для методики экстракционно-фотометрического определения ванадия с N-БФГА соблюдается в пределах концентрации ванадия 0.7-12 мкг/л при л=510 нм. При концентрации соляной кислоты 2.8-4 М образуется комплекс, имеющий максимум поглощения при 510 нм и молярный коэффициент погашения 4650. Метод позволяет определять ванадий при содержаниях более 40 мкг/л. Ванадий(IV) в сильнокислых растворах с N-БФГА не взаимодействует. Таким образом, можно считать, что в сильнокислых растворах N-БФГА является специфическим и высокочувствительным реагентом для определения ванадия(V).
Обычно встречающиеся катионы определению ванадия с N-БФГА не мешают. Мешают окислители, разрушающие реагенты, и восстановители, изменяющие валентность ванадия. Особенность взаимодействия ванадия(V) с N-БФГА состоит в том, что комплекс с ванадием избирательно экстрагируется из сильно кислых (5-9 М по HCl) растворов хлороформом. В аналогичных условиях экстрагируются цирконий, титан, олово(IV), ниобий(V), тантал, церий(IV), плутоний(IV), молибден(VI), вольфрам(VI) [67]. Однако либо содержание в пробах природных вод соответствующих металлов ничтожно (ниобий, тантал, цирконий, плутоний) либо образуемые ими комплексы с N-БФГА не поглощают излучение в видимой области (титан, олово(IV), церий, молибден(VI), вольфрам(VI)). Кроме того, в сильно кислых растворах комплексы большинства ионов с этим реагентом неустойчивы, тогда как комплекс ванадий-N-БФГА вполне устойчив, а его окраска развивается мгновенно. Избирательная экстракция ванадия(V) из сильно солянокислых сред в широком интервале кислотности позволяет определять весьма малые его количества без введения дополнительных маскирующих агентов.
В последние годы синтезировано большое число новых органических производных гидроксиламина. Проведено сравнительное изучение цветных реакций ванадия(V) с реагентами, содержащими ароматические или гетероциклические радикалы (бензоил-, метоксифенил-, фенилацетил-, о-, м-, п-толил-, 2-фуроил-, 2-теноил-, циннамоил- и др.) в различных комбинациях [68,69], а также с ненасыщенными гидроксамовыми кислотами.
В результате для определения ванадия (V) рекомендованы N-2-теноил-N-п-толил- и N-2-теноил-N-фенил- [70], N-м-толил-N-о-метоксибензоил- [68], N-толил-N-циннамоил- [69], N-п-толил-N-2-фуроил- [71], N-2-фуроил-N-фенил- [72], N-о-метоксифенил-N-2-теноил- [73], N-бензоил-N-о-толил- [74], N-циннамоил-N-фенилгидроксиламины [75]. Эти реагенты по чувствительности и избирательности превосходят БФГА. Их сравнительная характеристика приведена в табл.2. Все реагенты в 2,5 – 8 М HCl при достаточном избытке реагента образуют с ванадием хелатные соединения в отношении 2:1. Соединения экстрагируются органическими растворителями, преимущественно хлороформом. Молярные коэффициенты погашения при 510 – 555 нм равны (3-7)·103. Они отличаются в основном по избирательности. Определению ванадия с большинством реагентов этого типа мешают титан(IV), молибден(VI), ниобий(V), цирконий(IV) и гафний(IV).
Одним из наиболее избирательных реагентов является N-м-толил-N-о-метоксибензоилгидроксамовая кислота. Определению ванадия с ним не мешают щелочные и щелочно-земельные металлы, Ti(IV), Zr(IV), Cr(III), Mn(II), Fe(III), Co, Ni, Cu(II), Zn, Cd, Hg(II), Pb, Al, As(III), РЗЭ и анионы Cl-F-, PO43-, C2O42-, цитраты и тартраты [71].
Таблица 2. Определение ванадия(V) с производными гидроксиламина.
Дата публикования: 2014-11-18; Прочитано: 956 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
