 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Основы теории электрокапиллярных явлений. Потенциалы нулевого заряда и нулевые точки металлов
|
|
Уравнение – 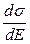 = qHg,
= qHg,
хорошо описывающее форму электрокапиллярных кривых и устанавливающее связь между поверхностным натяжением, потенциалом и зарядом на границе ртуть – раствор, называется первым уравнением Липпмана. Это уравнение определяет наклон в любой точке электрокапиллярной кривой, взятый с обратным знаком, как величину, равную удельному заряду поверхности ртути при данном значении потенциала E. Из уравнения следует, что на восходящей ветви кривой qHg > 0 (dE всегда < 0, на восходящей ветви ds > 0, отсюда – ds/dE > 0), в точке максимума qHg = 0 (так как ds/dE = 0), а на нисходящей ветви qHg < 0 (– ds/dE < 0).
Первое уравнение Липпмана позволяет по экспериментальным э.к.к. вычислить заряд при любом значении потенциала и построить кривые заряд поверхности ртути – потенциал. Так как заряд поверхности ртути можно измерить непосредственно, то имеется возможность проверить справедливость формулы Липпмана. Для этого нужно сопоставить расчетные и экспериментальные значения заряда. Такая проверка была осуществлена А.Н.Фрумкиным. Полученные результаты показали количественную применимость уравнения Липпмана к электрокапиллярным кривым.
Поскольку первое уравнение Липпмана определяет величину заряда независимо от его происхождения, оно приложимо к э.к.к., полученным в любых растворах, в том числе и в растворах, содержащих ПАВ. При одном и том же потенциале и заряд, и его знак могут быть различными в зависимости от природы присутствующих в растворе частиц (см. рис. 19, а: в растворе KNO3 заряд отрицательный, в растворе KBr равен 0, а в растворах KJ и K2S – положительный). Таким образом, анализ э.к.к., так же как и данные, полученные при изучении электрокинетических явлений, указывают на возможность перезарядки поверхности металла в присутствии ПАВ при сохранении неизменной общей величины скачка потенциала между металлом и раствором.
Известно, что производная от заряда по потенциалу дает дифференциальную емкость Cd, то есть величину, характеризующую изменение заряда с потенциалом:
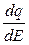 = Cd.
= Cd.
Из этого выражения и первого уравнения Липпмана следует второе уравнение Липпмана:
– 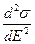 =
= 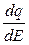 = Cd;
= Cd;
dq = Cd dE; 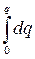 =
=  .
.
Так как в точке максимума э.к.к. q = 0, a E = Eq=0, то интегрирование дает
q = C (E – Eq=0 ), C = 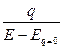 ,
,
где С – интегральная емкость при потенциале E. Связь между величинами С и Cd передается уравнениями
Cd = С + (E – Eq=0 ) 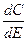 ; С =
; С = 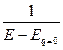
 .
.

| Рис. 21. Изменение с потенциалом Е поверхностного натяжения s, заряда поверхности металла q и емкости двойного слоя С на границе раздела ртуть – раствор поверхностно-инактивного электролита |
По кривым дифференциальная емкость – потенциал, которые сравнительно легко получаются экспериментально не только на ртути, но и на твердых металлах, можно последовательным интегрированием определить заряд электрода
q = 
и поверхностную энергию
s = const – 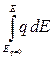 ,
,
const = smax при потенциале нулевого заряда (в точке максимума э.к.к.).
Поверхностное натяжение является функцией состава раствора. Эта зависимость была математически выражена Гиббсом на основании термодинамики поверхностной фазы. Запишем уравнение Гиббса – Дюгема для поверхностной фазы:
Vd р – SdT – sds – å ni d 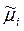 = 0.
= 0.
При р, Т = const
– sds – å ni d 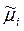 = 0.
= 0.
Разделим левую часть уравнения на площадь поверхности раздела s и получим
– ds – å Г i d 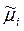 = 0 или ds = – å Г i d
= 0 или ds = – å Г i d 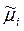 .
.
Это уравнение называется адсорбционной формулой Гиббса или изотермой адсорбции Гиббса.
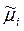 = mi + q i j, d
= mi + q i j, d 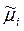 = d mi + q i dj = d mi + q i dE;
= d mi + q i dj = d mi + q i dE;
– ds – qdE – å Г i d mi = 0 или ds = – qdE – å Г i d mi,
где q = å q i. Вышеприведенное уравнение является основным уравнением электрокапиллярности. Зная поверхностные избытки, можно, используя это уравнение, определить заряд поверхности металла, а затем и емкость ДЭС. И наоборот, электрокапиллярные измерения позволяют определить поверхностные избытки компонентов раствора. Из этого уравнения, при условии постоянства состава раствора (d mi = 0), получается первое уравнение Липпмана (уточненное):
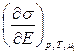 = – q.
= – q.
Потенциалы нулевого заряда и нулевые точки металлов
Из уравнения Липпмана следует, что в точке максимума э.к.к. заряд поверхности металла равен нулю. Оствальд предположил, что в точке максимума э.к.к. нулю равен также и потенциал электрода, поэтому именно его следует взять за основу шкалы потенциалов. Такая шкала была названа абсолютной или оствальдовской шкалой потенциалов. Так как потенциал максимума э.к.к. в растворах ПИАВ составляет» – 0,2 В (по н.в.э.), то, по Оствальду, для получения абсолютного потенциала какого-либо электрода надо из значения его электродного потенциала по водородной шкале вычесть – 0,2 В. Однако полученные таким образом потенциалы в свете современных представлений нельзя считать абсолютными. Скачок потенциала на границе электрод – раствор не эквивалентен электродному потенциалу, а составляет лишь некоторую его часть; необходимо учесть еще и контактную разность потенциалов между металлом (в данном случае ртутью) и платиной. Кроме того, скачок потенциала металл – раствор включает в себя, помимо слагаемого, возникающего за счет ионного обмена (который в точке максимума э.к.к. равен нулю), также слагаемое, обязанное ориентации диполей растворителя, и нет оснований считать, что в точке максимума э.к.к. этот скачок потенциала равен нулю.
Если бы Оствальд был прав, то максимум э.к.к. находился бы всегда при одном и том же значении электродного потенциала независимо от состава раствора и от природы металла. Такое предположение не оправдывается на опыте. Было найдено, что положение максимума э.к.к. оказывается иным, если вместо ртути использовать легкоплавкие сплавы или амальгамы. Таким образом, потенциалы максимумов э.к.к. не могут служить основанием для создания абсолютной шкалы потенциалов. В то же время эти потенциалы, названные Фрумкиным потенциалами нулевого заряда или нулевыми точками металлов, имеют принципиальное значение в электрохимии. На их основе Фрумкину удалось дать одно из наиболее удачных решений проблемы Вольта.
Термины «потенциал нулевого заряда» и «нулевая точка» употреблялись как синонимы. Антропов предложил разграничить эти понятия, присвоить каждому из них свой символ и употреблять в соответствии с их содержанием. Потенциал нулевого заряда (п.н.з.; Еq=0 ), подобно равновесному потенциалу, может для данного металла и растворителя приобретать любые значения в зависимости от состава раствора, то есть он не является специфической константой. Только одно значение потенциала нулевого заряда, полученное в растворе, не содержащем ПАВ (или непосредственно в чистом растворителе), может рассматриваться как константа (при данных р и Т), характеризующая систему металл – растворитель. Это частное значение потенциала нулевого заряда целесообразно назвать нулевой точкой (н.т.; ЕN ). Нулевая точка, подобно стандартному потенциалу, отвечает вполне определенному составу раствора. Нулевую точку можно попытаться рассчитать теоретически, используя определенные физические свойства металла и растворителя.
Определенная таким образом нулевая точка была выбрана за нуль в приведенной шкале, или j- шкале, потенциалов, предложенной Антроповым. Потенциал j в приведенной шкале определяется как разность между потенциалом электрода в данных условиях и его нулевой точкой:
j = Е – ЕN.
Обе величины в правой части уравнения должны быть выражены в одной и той же условной (например, в водородной) шкале; j-потенциал при этом не зависит от выбранной условной шкалы. Поскольку для разных металлов величины ЕN не совпадают, то для каждого металла должна быть своя собственная приведенная шкала, основанная на его нулевой точке.
Приведенная шкала, следовательно, отличается и от любой условной, и от абсолютной шкалы потенциалов. В приведенной шкале для каждого электрода потенциал отсчитывается от своего собственного нуля; неверно поэтому применять j-шкалу для решения проблем, связанных с термодинамикой электрохимических систем или с электродным равновесием (нельзя определить направление реакции и ЭДС системы). Однако j-потенциал служит приближенной мерой заряда электрода по отношению к раствору. Равенство j-потенциалов двух металлов указывает на то, что ионные скачки потенциалов и заряды поверхности этих металлов примерно одинаковы. Знание j-потенциалов позволяет сравнивать различные металлы в отношении условий адсорбции на них ПАВ.
В некоторых случаях наряду с приведенной j-шкалой может оказаться полезной приведенная j¢-шкала, в которой отсчет ведется от п.н.з.:
j¢ = Е – Еq=o.
Подобная j¢-шкала относится к отдельной э.к.к., в то время как j-шкала – к данному электроду и растворителю.
Лекция 12
Дата публикования: 2014-11-19; Прочитано: 2071 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
