 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Природа ЭДС и электродного потенциала: теория возникновения ЭДС, гальвани-потенциал на границе двух металлов, гальвани-потенциал на границе металл – раствор
|
|
Природа ЭДС и электродного потенциала: теория возникновения ЭДС, гальвани-потенциал на границе двух металлов, гальвани-потенциал на границе металл – раствор
Теория возникновения электродного потенциала и ЭДС
Значение электродного потенциала в общем случае не совпадает ни с нернстовским потенциалом, ни с разностью между нернстовскими потенциалами металла и электрода H+½H2½Pt, так как включает в себя ещё и потенциал между данным металлом и платиной. Понятие об электродном потенциале поэтому сложнее, чем понятие о скачке потенциала между электродом и раствором, и не может быть сведено к нему. Так называемая физическая теория электрохимических систем, сформулированная Вольтой ещё в начале XIX века, отводила особое место контакту между двумя разнородными металлами. По этой теории ЭДС электрохимической системы считается равной вольта-потенциалу между двумя разнородными металлами, а скачок вольта-потенциала между металлом и раствором принимается равным нулю. Возникновение тока в электрохимической системе объясняется при этом следующим образом (см. рис. 17). Если привести в непосредственное соприкосновение два различных металла, то ЭДС не возникнет, так как
E = 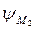 –
– 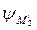 =
= 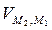 +
+ 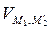 =
= 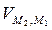 –
–  = 0.
= 0.
Если непосредственный контакт между двумя металлами заменить их контактом через токопроводящий раствор, то ЭДС уже будет равна не нулю, а величине
E = 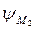 –
– 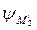 =
= 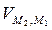 +
+  +
+  =
= 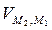 ,
,
потому что  и
и 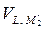 = 0. В результате через систему потечёт электрический ток, то есть она будет генерировать электрическую энергию.
= 0. В результате через систему потечёт электрический ток, то есть она будет генерировать электрическую энергию.
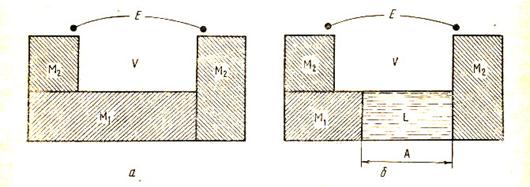
|
| Рис. 17. Схема, иллюстрирующая появление ЭДС при переходе от системы, составленной из двух металлов (а), к системе из тех же двух металлов, но разделенных слоем раствора (б), согласно представлениям физической теории |
Вместе с тем в химической теории предполагается, что ЭДС электрохимической системы слагается только из двух скачков потенциала, возникающих на тех границах раздела, где протекают токообразующие химические реакции, то есть на границах раздела электрод – электролит. При этом электродные потенциалы отождествляются со скачками потенциалов между электродом и раствором, а ЭДС – с разностью этих скачков:
Е = 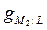 –
– 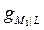 . (1)
. (1)
Роли скачка потенциала на стыке двух металлов в появлении ЭДС теория не учитывает. Эти представления химической теории не отвечают действительности, и ЭДС электрохимической системы слагается из трёх скачков потенциала.
Характер связи между ЭДС и отдельными скачками потенциала можно выяснить на примере электрохимической системы, состоящей из двух металлов, опущенных в растворы их токопроводящих соединений:
М1ïМ1АïïМ2АïМ2ïМ1.
Её ЭДС определяется уравнением E = V2,1 – VL,1 + VL,2 , так как диффузионный потенциал на границе двух растворов элиминирован. Если каким либо способом (например, подбором соответствующих составов растворов М1А и М2А) устранить скачки потенциала VL,1 и VL,2 , то ЭДС системы, вопреки представлениям химической теории, будет равна не нулю, а вольта-потенциалу металл 1 – металл 2:
E = jп – jл = V2, 1. (2)
Электродные потенциалы, отвечающие таким вполне реализуемым на опыте условиям, были названы А.Н.Фрумкиным потенциалами нулевого заряда.
Имеются, однако, электрохимические системы, например, простая химическая цепь с газовыми электродами
PtïH2 ïH2OïO2 ïPt,
в которых вообще нет контакта между двумя разными металлами и, следовательно, потенциал 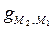 не участвует в создании ЭДС. В подобных случаях ЭДС системы определяется уравнением (1), которое является прямым следствием химической теории. Наличие потенциала между двумя разными металлами нельзя считать, таким образом, обязательным условием появления ЭДС и получения энергии от электрохимической системы. Электрическую энергию можно получать, вопреки представлениям физической теории, от электрохимической системы, в которой оба электрода сделаны из одного и того же металла.
не участвует в создании ЭДС. В подобных случаях ЭДС системы определяется уравнением (1), которое является прямым следствием химической теории. Наличие потенциала между двумя разными металлами нельзя считать, таким образом, обязательным условием появления ЭДС и получения энергии от электрохимической системы. Электрическую энергию можно получать, вопреки представлениям физической теории, от электрохимической системы, в которой оба электрода сделаны из одного и того же металла.
Таким образом, в зависимости от конкретных условий ЭДС электрохимической системы определяется либо гальвани-потенциалом между двумя разнородными металлами, либо гальвани-потенциалами на стыке металлов и раствора, либо всеми тремя скачками потенциала. Иными словами, в одних случаях реализуется механизм образования ЭДС, постулированный физической теорией, в других – химической, в третьих – все скачки потенциала вносят свой вклад в величину ЭДС, то есть в какой-то мере каждая из двух теорий отражает истинные соотношения. В этом состоит одно из решений так называемой проблемы Вольты, данное А.Н.Фрумкиным и основанное на концепции потенциалов нулевого заряда.
Гальвани-потенциал на границе двух металлов
Электродный потенциал представляет собой сложную величину, определяемую тремя отдельными скачками потенциала: скачком потенциала на границе металл электрода – платина и скачками потенциала на границах металл – раствор и платина – раствор. Теория возникновения электродного потенциала должна основываться поэтому на определённых представлениях о природе как скачка потенциала между двумя металлами, так и скачка потенциала на границе металл – раствор.
Рассмотрим вначале гальвани-потенциал g1,2 между двумя металлами. Соотношение, существующее между вольта- и гальвани-потенциалами, можно найти, используя правило, по которому сумма всех работ переноса элементарного заряда по замкнутому контуру равна нулю (см. рис. 18):
cV,1 + g1,2 + c2,V + V2,1 = 0,
g1,2 = V1,2 + c1,V – c2,V. (3)

| Рис. 18. Связь между вольта- и гальвани-потенциалами на границе двух металлов |
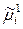 –
– 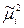 =
= 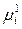 –
– 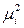 + zi F (
+ zi F ( –
– 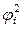 ) =
) = 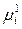 –
– 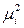 + zi Fg1,2. (4)
+ zi Fg1,2. (4)
В условиях равновесия 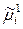 –
– 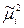 = 0 и
= 0 и
g1,2 = (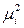 –
– 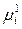 )/ zi F. (5)
)/ zi F. (5)
Если обе фазы – металлы, то в обмене между ними участвуют электроны, заряд которых zi F = – F. Для этого случая можно написать
g1,2 = 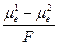 . (6)
. (6)
Уравнение (6) могло бы служить основой для расчёта гальвани-потенциала, если бы были известны химические потенциалы электронов в двух фазах. Однако, как уже отмечалось, определить для заряженных частиц изменение только химических потенциалов невозможно, поскольку при их переносе из одной фазы в другую одновременно с химической работой совершается также и электрическая.
Получим выражение для вольта-потенциала между фазами 1 и 2: подставим значение g1,2 из уравнения (3) в уравнение (4):
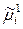 –
– 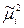 =
= 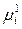 –
– 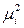 + zi Fc1,V – zi Fc2,V + zi F V1,2 =
+ zi Fc1,V – zi Fc2,V + zi F V1,2 =
(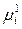 + zi Fc1,V) – (
+ zi Fc1,V) – (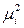 + zi Fc2,V) + zi F V1,2 = –
+ zi Fc2,V) + zi F V1,2 = – 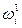 +
+ 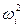 + zi F V1,2.
+ zi F V1,2.
V1,2 =  . (7)
. (7)
Для частного случая контакта двух металлов
V1,2 = 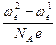 (8)
(8)
(w е – работа выхода электрона из металла).
Работа выхода электрона доступна непосредственному экспериментальному определению, и поэтому при помощи уравнения (8) можно рассчитать величину вольта-потенциала. Чем меньше работа выхода электрона из данного металла, тем при данной температуре большее число электронов может покинуть металл и перейти в вакуум и тем положительнее будет заряд обкладки дипольного слоя в металле. Если сблизить два металла с различными работами выхода, то электроны будут переходить от металла с меньшей работой выхода к металлу с большей. В результате этого первый металл зарядится положительно, а второй – отрицательно. Например, для пары Cu½Zn VCu, Zn = 0,3 В, тогда как ЭДС системы Zn½ZnSO4½CuSO4½Cu равна 1,11 В. Таким образом, потенциал V1, 2 составляет заметную долю обратимой ЭДС электрохимической системы.
Гальвани-потенциал на границе металл – раствор
Дата публикования: 2014-11-19; Прочитано: 1848 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
