 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Зависимость скорости реакции от концентраций реагентов
|
|
Влияние концентраций реагирующих веществ на скорость реакции выражается основным законом химической кинетики или законом действующих масс:
Скорость химической реакции, протекающей при постоянной температуре в гомогенной среде, пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициентам, стоящим перед формулами этих веществ в уравнении реакции.
Так, для реакции, протекающей по уравнению:
aA + bB = cC + dD,
скорости прямой и обратной реакций определяются выражениями:

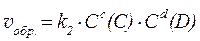
где k1 и k2 – константы скоростей прямой и обратной реакций.
Необходимо отметить, что данное определение справедливо только для простых реакций, т.е., для реакций, в которых порядок реакции совпадает со стехиометрическими коэффициентами уравнения реакции и может быть равен молекулярности.
Уравнения, выражающие зависимость скорости химических реакций от концентраций реагентов, называют кинетическими.
Коэффициент пропорциональности k называют константой скорости химической реакции.
Величина k зависит от природы реагирующих веществ, температуры, наличия катализатора и не зависит от концентрации реагирующих веществ. Физический смысл константы скорости реакции заключается в следующем: она равна скорости реакции в случае, если концентрации всех реагирующих веществ равны и составляют 1 моль/л.
Например:
H2(газ) + I2(газ) ⇄ 2HI(газ)
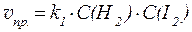 ;
;
 .
.
Если система гетерогенна, то концентрация твердой фазы в кинетическом уравнении учитывается в значении константы скорости (т.е., в явном виде в уравнении не присутствует):
S(тв) + O2(газ) ⇄ SO2(газ)
 ;
;
 .
.
Дата публикования: 2014-11-18; Прочитано: 575 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
