 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры электролиза водных растворов солей
|
|
В качестве примеров рассмотрим электролиз водных растворов электролитов, у которых катионы занимают различное положение в ряду стандартных электродных потенциалов металлов, а анионы образованы кислородными и бескислородными кислотами.
1. Электролиз водного раствора соли, образованной малоактивным металлом и бескислородной кислотой с нерастворимым анодом.
Рассмотрим электролиз водного раствора бромида меди (CuBr2) с угольными электродами.
Схема электролиза:


Суммарное уравнение:
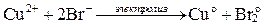
или

2. Электролиз водного раствора соли, образованной активным металлом и кислородной кислотой.
В качестве примера рассмотрим электролиз водного раствора сульфата калия (K2SO4) с угольными электродами.
Сульфат калия как сильный электролит диссоциирует на ионы:


Суммарные уравнения:
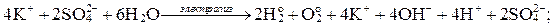
2 


Следовательно, электролиз водного раствора сульфата калия сводится к электролизу воды, а количество растворенной соли остается неизменным.
3. Электролиз водного раствора соли, образованной активным металлом и бескислородной кислотой.
В качестве примера рассмотрим электролиз водного раствора хлорида калия (KCl) с угольными электродами.
Схема электролиза водного раствора хлорида калия:

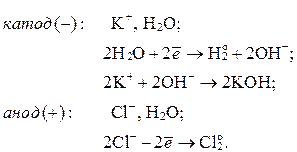
Суммарное уравнение реакции:

или
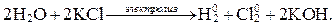
4. Электролиз водного раствора соли, образованной металлом средней активности и кислородной кислотой.
К данному типу относится соль нитрата цинка (Zn(NO3)2). В водном растворе нитрат цинка диссоциирует на ионы:
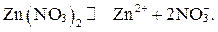
Схема электролиза:

Суммарное уравнение реакции:


5. Электролиз водного раствора соли, образованной малоактивным металлом и кислородной кислотой с растворимым анодом.
Рассмотрим электролиз сульфата меди (CuSO4) с анодом из неочищенной меди.
Схематически процесс можно изобразить следующим образом:
|

Суммарное уравнение:
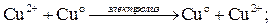

6. Электролиз водного раствора соли, образованной металлом средней силы, когда анод растворим.
В качестве примера рассмотрим две соли:
а) с анионом кислородной кислоты – ZnSO4;
б) с анионом бескислородной кислоты – ZnCl2.
Катодные процессы в 1-м и во 2-м случаях будут одинаковы, т.к. соли образованы одним и тем же металлом средней активности (см. приложение):

На катоде происходит выделение цинка и водорода, а на аноде растворяется сам цинковый анод (пример (а)):

а для соли ZnCl2 при высокой концентрации ионов Cl– и больших значениях их потенциалов возможно выделение еще и хлора (пример (б)).
Суммарные уравнения электролиза:
а) 
б) 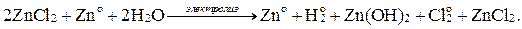
Дата публикования: 2014-11-18; Прочитано: 14953 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
