 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Электрохимическая коррозия
|
|
Электрохимическая коррозия характерна для сред, имеющих ионную проводимость:
- в электролитах – водных растворах солей, кислот, щелочей, в морской воде;
- в атмосфере любого влажного газа;
- в почве.
Электрохимическая коррозия – это разрушение металлов в среде электролита, сопровождающееся возникновением в системе электрического тока.
При электрохимической коррозии процесс воздействия металла с окислителем состоит из анодного растворения металла и катодного восстановления окислителя:
анодный процесс: Me – n 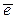 = Me n +;
= Me n +;
катодный процесс: а) в кислой среде (водородная деполяризация)
2H+ + 2  = H2;
= H2;
б) в нейтральной или слабощелочной среде (кислородная деполяризация)
2H2O + O2 + 4  = 4OH–.
= 4OH–.
Например, атмосферное разрушение железа происходит за счет кислородной деполяризации. Ее характеризуют следующие химические уравнения:
анодный процесс: Feo – 2  = Fe2+
= Fe2+
Fe2+ –  = Fe3+;
= Fe3+;
катодный процесс: 2H2O + O2 + 4  = 4OH–.
= 4OH–.
Суммарное уравнение: 2Feo + 2H2O + O2 = 2Fe(OH)2;
4Fe(OH)2 +2H2O + O2 = 4Fe(OH)3.
Продуктом разрушения железа при атмосферной коррозии является бурая ржавчина FeOOH, продукт дегидротации гидроксида железа (III):
Fe(OH)3 → FeOOH + H2O.
Контактная коррозия имеет место тогда, когда соприкасаются металлы разной активности в присутствии электролита. Два металла одновременно разрушаться не могут, разрушается один из них, который является более активным. В этом случае, при написании электродных уравнений процесса электрохимической коррозии, пользуются рядом активности металлов (см. приложение, табл. 7).
В качестве примера рассмотрим процессы, происходящие при коррозии оцинкованного железа, т.е. железа, покрытого слоем цинка, в растворе соляной кислоты (рис. 9). Процессы, протекаемые в такой системе, подобны процессам, происходящим во внутренней цепи гальванического элемента. В этой паре (Zn/Fe) цинк, как более активный металл (E o = – 0,763 В), является анодом, железо (E o = – 0,440 В) – катодом.

Рис. 9. Схема механизма электрохимической контактной коррозии цинка
с водородной (рН < 7) и кислородной (рН ≥ 7) деполяризацией
На аноде протекает процесс растворения окисления цинка:
анодный процесс: Zno – 2  = Zn2+.
= Zn2+.
На катоде – процесс восстановления активных ионов среды (H+), так как процесс протекает в кислой среде:
катодный процесс: 2H+ + 2  = H2 (
= H2 ( ).
).
Суммарное уравнение: Zno + 2H+ = Zn2+ + H2;
Zno + 2HCl+ = ZnCl2 + H2.
Схема гальванического элемента:
(–)Zno/Zn2+|HCl|2H+/H2[Fe](+).
Данный пример контактной коррозии железа в паре с цинком можно рассматривать как один из методов защиты металлов от коррозии, а именно металлическое покрытие, роль которого для железа выполнял цинк. В этих условиях цинк являлся анодом и при этом разрушался, железо – пассивным электродом – катодом, оказался защищенным от разрушения. Вид защиты – металлическое, анодное покрытие.
На скорость электрохимической коррозии оказывает влияние:
- чистота металла: чем металл чище, т.е. чем меньше в нем примесей, тем он в меньшей степени подвергается разрушению;
- сплавы металлов разрушаются быстрее, чем металл в отдельности;
- среда, в которой протекает коррозионное разрушение: в кислой среде (рН < 7) быстрее, за счет легких и высокоподвижных ионов водорода (Н+), несколько медленнее – в нейтральной среде (рН = 7), за счет кислорода, растворенного в воде (2H2O + O2), и практически с нулевой скоростью – в щелочной среде (pH > 7).
Чтобы предохранить металл от коррозии, применяют следующие основные способы защиты.
1. Защитные покрытия (металлические, неметаллические, химические: органические и неорганические).
2. Воздействие на среду с целью снижения ее коррозионной активности (подщелачивание кислой среды и деаэрация сред с высоким содержанием кислорода).
3. Изменение состава или структуры металлов, ведущее к повышению их коррозионной стойкости.
4. Электрохимические методы (протекторная, катодная, анодная и дренажная защиты).
Дата публикования: 2014-11-18; Прочитано: 5356 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
