 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Физико-химические свойства биоорганических соединений
|
|
Цель работы: Изучение физико-химических свойств липидов, углеводов и белков.
Теория: Липиды (жиры и жироподобные вещества), углеводы (сахара), аминокислоты, белки и нуклеиновые кислоты: общая характеристика, строение, биохимические свойства.
Липиды – нерастворимые в воде (гидрофобные) органические вещества – жиры и жироподобные вещества (воска, стеролы). Жиры – сложные эфиры глицерина и высокомолекулярных жирных кислот. Биологическое значение: энергетическая, запасающая, структурная, защитная, регуляторная функции.
Углеводы (сахара) – это природные органические соединения, имеющие общую формулу Сm(Н2О)n. Моносахариды: С6Н12О6 – глюкоза и фруктоза (энергетическая функция в живых организмах); олигосахариды: С12Н22О11 – сахароза (главный источник углеводов в пище человека), мальтоза, лактоза; полисахариды: (С6Н10О5)n – крахмал (запасной сахар растений), целлюлоза (основное вещество растительных клеток), хитин (основа наружного скелета членистоногих), гликоген (запасной сахар животных). 
Белки – природные полипептиды с высокими значениями молекулярной массы, состоящие из аминокислот. В составе белков 20 аминокислот. Белки входят в состав всех живых организмов и выполняют разнообразные биологические функции (строительную, ферментативную, транспортную, защитную, рецепторную и др.).
Оборудование и реактивы
Водяная баня, воронка, обратные холодильники, пробирки, стеклянная палочка, фарфоровая чашка, фильтровальная бумага, термометр.
Подсолнечное масло (нерафинированное), бензин, диэтиловый эфир, этиловый спирт, хлороформ; лакмус, универсальная индикаторная бумага;
Растворы: серная кислота H2SO4 (конц.), бромная вода (насыщенная), перманганат калия KMnO4 (1%), гидроксид натрия NaOH (10%), глюкоза (1%), сахароза (1%), CuSO4 (5%), крахмальный клейстер (1%), йод (раствор Люголя), белок (одно куриное яйцо и 0,2 л 3%-ного раствора NaCl), азотная кислота HNO3 (конц.), аммиак NH3 (конц.), гидроксид натрия NaOH (10%), сульфат меди (II) CuSO4 (5%), нингидрин (0,1% раствор в ацетоне), ацетат свинца (II) (СН3СОО)2Рb (0,5%),
Эксперимент: выполните задания, составьте уравнения реакций, назовите вещества, запишите наблюдения и вывод.
Опыт 1. Растворимость жиров в органических растворителях
В шесть пробирок внесите по 2–3 капли подсолнечного масла, а затем добавьте по 2 мл следующих растворителей: в первую – ацетон, во вторую – диэтиловый эфир, в третью – хлороформ, в четвертую – бензин, в пятую – этиловый спирт, в шестую – дистиллированную воду. Содержимое пробирок энергично встряхните. Наблюдения занесите в таблицу.
Пробирки с эмульсиями закройте пробкой с обратным холодильником, нагрейте на водяной бане до кипения. Растворимость растительного масла увеличивается (уменьшается). Наблюдения занесите в таблицу: «+» хорошая растворимость; «–» плохая растворимость; «±» частичная растворимость.
| Исходный препарат | Температура | Растворитель | |||||
| Ацетон | Диэтиловый эфир | Хлороформ | Бензин | Этиловый спирт | Дистил. вода | ||
| Масло | tкомн. = | ||||||
| Свиной жир | |||||||
| Масло | tвод.бани = | ||||||
| Свиной жир |
Опыт 2. Определение непредельности растительного масла
2.1. Реакция с бромной водой
В пробирку внесите 0,5 мл растительного масла и 1–2 мл насыщенной бромной воды. При встряхивании содержимое пробирки _________, вследствие присоединения брома к остаткам непредельных жирных кислот:
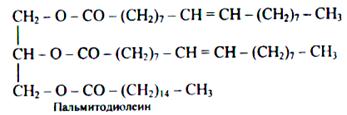
2.2. Реакция с водным раствором перманганата калия (реакция Вагнера)
В пробирку внесите 0,5 мл растительного масла и 1 мл 10%-ного раствора перманганата калия KMnO4. При встряхивании содержимое пробирки _________________, вследствие окисления остатков непредельных высших жирных кислот.
Опыт 3. Реакция на холестерин
В пробирку к 1 мл хлороформа добавьте немного растительного масла и 1 каплю конц. серной кислоты. Наблюдайте образование на границе двух растворов _____ окрашивания – продукт дегидратации холестерина.
Опыт 4. Взаимодействие сахаров с гидроксидом меди ( II) в щелочном растворе
К 2 мл 1% раствора глюкозы (1 пробирка) и сахарозы (2 пробирка) добавляют по 1 мл 10%-ного раствора NaOH и 2–3 капли 5%-ного раствора CuSO4. Встряхните каждую пробирку. Запишите наблюдения. Эта реакция доказывает ______________, т.е. она характерна для многоатомных спиртов. Уравнение реакции взаимодействия глюкозы (циклическая форма) с гидроксидом меди (II) с образованием сахарата меди (II) имеет вид:
|
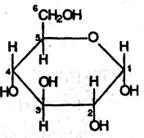
Затем осторожно нагрейте в пламени спиртовки верхнюю часть жидкости в каждой пробирке до начала кипения.
При этом в первой пробирке (глюкоза) наблюдаем ____________, во второй пробирке (сахароза) _____________. Что показывает эта реакция?
HOCH2(CHOH)4CH=O + 2Cu(OH)2 __t→HOCH2(CHOH)4COOH + 2CuOH↓ (желтый) + H2O
2CuOH↓ (желтый) → Cu2O↓ (красный) + H2O
Опыт 5. Взаимодействие крахмала с йодом
В пробирку налейте 1 мл 1%-ного раствора крахмального клейстера и добавьте 1–2 капли раствора йода. При этом появляется _____________. Нагрейте полученную смесь, наблюдаем _____________.
При дальнейшем охлаждении окраска _____________. Запишите схематично взаимодействие йода с крахмалом.
Опыт 6. Цветные (качественные) реакции на белки
6.1. Биуретовая реакция. В пробирку налейте 1 мл раствора белка, добавьте 1–2 мл 10%-ного раствора NaOH и 1–2 капли 4%-ного раствора CuSO4. При взбалтывании появляется _______ окрашивание.
6.2. Нингидриновая реакция. К 2–3 мл раствора белка добавьте 2–3 капли 0,1%-ного раствора нингидрина в ацетоне. Содержимое пробирки перемешайте и нагрейте на кипящей водяной бане. Наблюдаем, что через 10–15 мин. Появляется ______ окраска.
6.3. Ксантопротеиновая реакция. Налейте в пробирку 1 мл раствора белка и прибавьте по 5–6 капель конц. HNO3. Наблюдаем _____. Нагрейте смесь в пламени спиртовки до появления желтого окрашивания. Охладите пробирку и осторожно добавьте избыток аммиака. Наблюдаем ____.
Опыт 7. Реакции осаждения белков
7.1. Необратимое осаждение белковсолями тяжелых металлов. В две пробирки налейте по 1–2 мл раствора белка, прибавьте по каплям в первую пробирку 0,5%-ный раствор (CH3COO)2Pb, во вторую – 5%-ный раствор CuSO4. Наблюдайте образование осадка в обеих пробирках. При добавлении избытка солей осадки ______.
7.2. Необратимое осаждение белков при нагревании. Налейте в пробирку 1–2 мл раствора белка и нагрейте на кипящей водяной бане. Наблюдаем _________.
Контрольные задания
1. Чем отличаются по химическому строению жидкие жиры от твердых? Приведите примеры.
2. Напишите структурную формулу триглицерида, образованного одним остатком пальмитиновой кислоты и двумя остатками олеиновой кислоты.
3. Напишите уравнение реакции щелочного гидролиза тристеарата глицерина.
4. При гидролизе жира на 1 моль стеариновой кислоты образовалось 2 моль олеиновой кислоты. Напишите уравнение реакции щелочного гидролиза такого жира.
5. Какая масса глицерина образуется при щелочном гидролизе 331,5 г триолеата.
6. В чем растворяются жиры? Охарактеризуйте степень растворения липидов в различных растворителях.
7. Какие функциональные группы входят в состав углеводов? Приведите примеры реакций.
8. Какими свойствами отличаются моно-, ди- и полисахариды?
9. Какие продукты обнаруживаются при гидролизе сахарозы? крахмала? целлюлозы? Какой вывод можно сделать о строении данных соединений?
10. Составьте уравнение реакции: а) присоединения Н2 к глюкозе; б) глюкоза → глюконовая кислота.
11. Напишите формулы пентоз: рибозы, дезоксирибозы. Их биологическое значение.
12. Какие дисахариды называют восстанавливающими и невосстанавливающими? Напишите их формулы.
13. Напишите уравнения реакции получения из целлюлозы: а) ди- и тринитрата целлюлозы; б) ацетата целлюлозы.
14. Привести уравнения реакций, подтверждающие амфотерность глицина.
15. Какие реакции доказывают амфотерные свойства белков?
16. Для чего в химическом анализе используется биуретовая и ксантопротеиновая реакции белков?
17. Приведите уравнение реакции образования соединений с пептидной связью.
18. Приведите структуры дипептидов, образованных аминокислотами: глицин, лизин.
19. Приведите структуры дипептидов, образованных аминокислотами: глицин, аланин.
20. Приведите структуры дипептидов, образованных аминокислотами: аланин, лизин.
Пример. С помощью каких реакций можно осуществить следующие превращения: сахароза → глюкоза → глюконовая кислота?
Решение
Сахароза гидролизуется при нагревании в подкисленном растворе:
С12Н22O11 + H2O → С6Н12O6 (глюкоза) + С6Н12O6 (фруктоза)
Глюкоза окисляется свежеосажденным гидроксидом меди (II) с образованием глюконовой кислоты (С6Н12О7):
CH2OH–(CHOH)4–CH=O + 2Cu(OH)2 → CH2OH–(CHOH)4–COOH + Cu2O↓ + 2H2O
Дата публикования: 2014-11-04; Прочитано: 1160 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
