 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Раздел 2. Токсикодинамика 4 страница
|
|
Очевидно, что если такой химический окислительно-восстановительный цикл превращения ксенобиотика будет продолжаться в течение достаточно длительного времени, механизмы клеточной защиты могут истощиться и произойдет повреждение клетки. Такая возможность вполне вероятна, поскольку известно, что супероксид-анион инактивирует супероксиддисмутазу, превращает аскорбиновую кислоту и токоферол, а гидроксильный радикал - угнетает глутатионпероксидазу.
Помимо гладкого эндоплазматического ретикулума оксидазы смешанной функции обнаружены в мембране ядра клетки. Поскольку эта мембрана окружает хроматин, активация здесь ксенобиотиков и образование свободных радикалов представляет угрозу ДНК, либо вследствие прямого взаимодействия метаболитов с нуклеиновыми кислотами, либо опосредованно, путем образования реактивных метаболитов кислорода или продуктов перекисного окисления липидов - компонентов ядерной мембраны.
Помимо упомянутых выше, в образовании активных радикалов могут принимать участие и другие энзимы. Так, ксантиноксидаза участвует в метаболизме адриамицина, нитрофурантиола, параквата до продуктов их одноэлектронного восстановления. Тирозиназа, в большом количестве содержащаяся в клетках меланом участвует в образовании многих реактивных метаболитов. Цитоплазматическая диафораза и простогландинсинтетаза облегчают формирование окислительно-восстановительного цикла трансформации параквата, ацетаминофена, бенз(а)пирена и т.д.
Таким образом, можно выделить несколько ключевых моментов, имеющих особое значение для реализации повреждающего действия ксенобиотиков на клетку, путем активации свободно-радикальных процессов:
1. Образовавшись, радикал - промежуточный продукт может иметь несколько способов дальнейшего превращения, соотношение между которыми зависит от степени оксигенации клеток (тканей);
2. Усиленное образование свободных радикалов может начаться в нескольких независимых локусах клетки (эндоплазматическом ретикулуме, митохондриях, ядре, цитоплазме);
3. Активация ксенобиотиков до активных радикалов может стать следствием последовательного действия на токсикант нескольких ферментов;
4. Возможно неэнзиматическое образование свободных радикалов. Превращение одного из ксенобиотиков может активировать превращение другого. Так, блеомицин повреждает ДНК в присутствии митомицина С и т.д.
3.4. Биологические последствия активации свободно-радикального процесса в клетке
В результате образования свободных агрессивных радикалов повреждаются самые разные структуры-мишени: липидные мембраны, свободные аминокислоты, полисахариды, нуклеиновые кислоты, рецепторные молекулярные комплексы, транспортные протеины. Итогом такого действия является изменение функционального состояния и гибель клетки, мутация её генетического кода, что, как уже указывалось, на уровне макроорганизма приводит к явлению массивной клеточной гибели (некроз), разрастанию соединительной ткани в органе (фиброз), мутагенезу, развитию новообразований в отдаленные периоды после действия токсиканта.
Характер повреждающего действия активных радикалов во многом определяется их стабильностью и расстоянием, на которое они могут мигрировать от места своего образования. В соответствии с этими признаками реактивные метаболиты могут быть разделены на несколько групп.
Наивысшей реакционной способностью обладают промежуточные продукты, образующиеся в ходе так называемого "суицидного метаболизма". Эти продукты разрушают образующие их энзимы. К числу "суицидных" ингибиторов Р-450 относятся, в частности, винилгалогены, некоторые олифены, дигидропиридины, циклопропильные соединения.
Следующими по реакционной способности являются вещества, покидающие область локализации фермент-субстратного комплекса, но активно взаимодействующие с другими протеинами. Примерами веществ, действующих подобным образом, являются: ацилгалидный метаболит хлорамфеникола, электрофильный радикал серы, отщепляющийся в ходе метаболизма паратиона и т.д.
Менее реакционноспособными являются продукты, мигрирующие в другие локусы клеток и даже за их пределы. Эта группа метаболитов включает большинство промежуточных продуктов. Подобные радикалы способны проникать через биологические мембраны. Это свойство присуще метаболитам бенз(а)пирена, бромбензола, диметилнитрозамина, винилхлорида, трихлорэтилена и т.д.
Еще меньшей раекционной способностью обладают метаболиты, способные выходить за пределы органов, в которых они образуются, и повреждають другие органы и ткани. Примерами этой группы метаболитолв являются: метаболит гексана - 2,5-гександион, вызывающий периферическую нейропатию, пирролизидиновых алкалоидов - пирролы, мигрирующие из печени в легкие, где действуют на эндотелий сосудов, эпоксиды 4-винилциклогексана, вызывающие поражение яичников.
Механизмы токсического действия свободных радикалов представлены на рисунке 14.
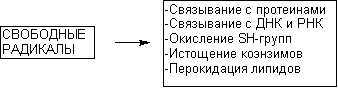
Рисунок 14. Некоторые токсические эффекты свободных радикалов
4. Повреждение мембранных структур
4.1. Основные свойства и функции биологических мембран
1. Плазматическая мембрана. Содержимое клетки отграничено от окружающей среды плазматической мембраной. Благодаря этому поддерживаются условия, позволяющие структурным элементам клетки выполнять присущие им функции. С другой стороны через плазматическую мембрану осуществляется непрерывный транспорт различных молекул, чем и обеспечивается обмен веществом между средой и клеткой. Например плазматическая мембрана печеночной клетки имеет площадь около 8000 мкм2. Такая большая площадь контакта с окружающей средой полностью обеспечивает обмен веществ клетки. Толщина плазматической мембраны составляет около 10 нм. Наконец в мембране локализуются белковые структуры, формирующие ионные каналы, рецепторы для физиологически активных веществ, обеспечивающие восприятие сигналов, регулирующих биологическую активность клетки (см. ниже).
Мембрана образована двумя слоями молекул липидов, гидрофобные части которых направлены друг к другу, а гидрофильные в сторону окружающей и внутренней среды клетки. Основные группы липидов - фосфолипиды (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, сфингомиелин), гликолипиды, нейтральные липиды (холестерол и т.д.). Молекулы липидов легко диффундируют в липидных слоях. Время нахождения отдельной молекулы на неизменной позиции составляет 10-8 - 10-9 сек. Обмен молекулами между слоями осуществляется редко. Распределение молекул различного строения между слоями асимметрично.
В мембрану встроены белковые молекулы, которые часто пронизывают всю ее толщу, либо погружаются на различную глубину, локализуясь на внешней или внутренней стороне. Углеводный компонент клеточной мембраны представлен главным образом гликопротеинами. Они располагаются на внешней поверхности мембраны. Мембраны различных клеток существенно различаются по своему строению и функциям. В клеточной мембране печени обнаруживается около 20 энзимов. Активность энзимов во многом зависит от липидного состава мембран. Особыми свойствами обладают возбудимые мембраны нервной, мышечной и железистой тканей. Изменение их свойств в ответ на стимул являются важнейшим звеном цепи биологических процессов, лежащих в основе формирования реакции организма на внешние и внутренние раздражители.
Плазматические мембраны, несмотря на преимущественно липидный состав, способны пропускать низкомолекулярные водорастворимые вещества, так как содержат поры со средним диаметром 0,7 - 1,0 нм. Полагают, что поры, заполненные водой, сформированы белковыми молекулами. Объем воды, содержащейся в мембранах, составляет от 30 до 50% от общего их объёма. Максимальная молекулярная масса водорастворимого вещества, способного проникать через плазматические мембраны, - около 200 дальтон.
Клеточные мембраны чрезвычайно динамичный элемент. Их строение изменяется в соответствии с условиями окружающей среды и потребностями клетки. Увеличение площади поверхности растущей клетки осуществляется за счет слияния клеточной мембраны с синтезируемыми в цитоплазме (аппарат Гольджи) микровезикулами. Этот же процесс обнаруживается и у не растущих секреторных и нервных клеток, которые путем отшнуровывания микровезикул выделяют в окружающую среду биологически активные вещества (гормоны, нейромедиаторы).
Известен и противоположный процесс - поступления необходимых веществ из окружающей среды в клетку, путем захвата фрагментом клеточной мембраны субстрата, погружением его в цитоплазму и отшнуровывания от остальной мембраны. Слияние мембраны с везикулами и их отшнуровывание обеспечивают динамичность её состава.
Важными свойствами клеточной мембраны является её электрический заряд и электрическая проводимость. Наружная сторона мембраны клеток в состоянии покоя заряжена положительно. Полярность мембраны определяется отчасти асимметричностью липидных слоев, отчасти наличием в её составе белковых молекул и гликопротеинов. Особое значение имеет градиент концентрации ионов по обе стороны мембраны, поддерживаемый благодаря энергозатратным процессам. Таким образом свойства мембраны и обмен веществ в клетке тесно связаны. Вещества, вмешивающиеся в обмен липидов, существенно влияют на свойства биологических мембран.
2. Цитоплазматические мембраны. Внутри клеток имеются многочисленные мембранные структуры, образующие эндоплазматический ретикулум, мембрану ядра клетки, митохондрии, аппарат Гольджи, лизосомы. Эти структуры образованы двумя слоями биологической мембраны. Между этими слоями имеется пространство толщиной около 10 нм. Общая толщина внутриклеточных мембран - около 25 нм.
Мембрана клеточного ядра представляет собой специализированный отдел эндоплазматического ретикулума. Пространство, находящееся между двумя листками мембраны, по-видимому сообщается с межклеточным пространством. Этим путем токсиканты могут проникать непосредственно в ядро, минуя цитоплазму, что прослеживается, в частности, при поступлении в клетку акридиновых красителей. Ионы Na+ также поступают в ядро из экстрацеллюлярной жидкости по эндоплазматическому ретикулуму. Наличие пор в ядерной мембране диаметром 50 - 100 нм обеспечивает обмен веществом между ядром и цитоплазмой. Даже макромолекулы (РНК, энзимы и др.) проходят через мембрану путем простой диффузии.
Цитоплазматические мембраны служат организующим субстратом для объединение в единый комплекс ряда энзиматических систем. Например, мембраны митохондрий представляют собой сложную мозаику взаимодействующих энзиматических групп. Складчатость мембран способствуют увеличению площади их поверхности и тем самым интенсификации обменных процессов. Общая площадь мембран митохондрий печеночной клетки оценивается в среднем в 29000 мкм2. В качестве матрикса для энзимов выступают и другие мембранные структуры: гладкий и шероховатый эндоплазматический ретикулум, аппарат Гольджи. Эти структуры участвуют в обмене веществ. Так, на рибосомах, локализующихся на мембранах шероховатого ретикулума, осуществляется синтез белка; энзимы гладкого эндоплазматического ретикулума - важнейший элемент метаболизма ксенобиотиков; аппарат Гольлджи - основная секреторная структура клетки.
Токсическое действие многих веществ сопряжено с их влиянием на состояние мембранных структур. Оно может быть прямым и опосредованным. Наиболее вероятными механизмами опосредованного повреждения биологических мембран при интоксикациях являются:
- активация перекисного окисления липидов;
- активация фосфолипазной активности.
4.2. Действие токсикантов на мембраны
4.2.1. Прямое действие на мембраны
Возможно действие ксенобиотиков непосредственно на липидный бислой или белковые компоненты биомембран. Развивающиеся вследствие этого эффекты могут быть как неспецифичными (отсутствие строгой зависимости между структурой токсиканта и развивающимся эффектом), так и строго специфичными. Специфичность является следствием действия токсикантов на энзимы и рецепторные белковые комплексы (см. выше). Часто действие носит смешанный "полуспецифический" характер.
В результате неспецифического действия многочисленных токсикантов (бензола, толуола, динитробензола, хлороформа, мылов, сапонинов, смачивающих веществ, тяжелых металлов и других денатурирующих агентов) может нарушаться структурная целостность мембран, что приводит к деформации, лизису клетки и её гибели. При действии таких веществ на мембраны эритроцитов развивается гемолиз.
Действуя в малых дозах на возбудимые мембраны нервных клеток ЦНС, органические растворители, спирты вызывают седативно-гипнотический. В действии этих соединений, помимо неспецифических, прослеживаются и отчетливые специфические механизмы. Так, вещества со свойствами "неэлектролитов" накапливаясь в мембранах, одновременно изменяют их проницаемость для ионов Na+, K+, Ca+2, Cl- (рис. 15).

|
 + Щелкните для загрузки увеличенной копии (7,4кб, 571x331 GIF) + Щелкните для загрузки увеличенной копии (7,4кб, 571x331 GIF)
|
| Рисунок 15. Возможные механизмы непосредственного действия токсикантов на биологические мембраны |

|
Многие токсиканты избирательно действуют на мембраносвязанные энзимы, транспортные системы, рецепторные комплексы к биологически активным веществам. К числу таких в частности относятся гликозиды, агонисты и антагонисты нейромедиаторов и гормонов, блокаторы ионных каналов и многие другие.
4.2.2. Активация перекисного окисления липидов
Благодаря ненасыщенности углеводородной цепи жирных кислот и непрочности связи аллильных атомов водорода с метиленовыми группами, фосфолипиды клеточных мембран наиболее предрасположены к реакции окисления, инициируемой свободными радикалами, образующимися в клетке. Этому способствует и то обстоятельство, что молекулярный кислород в 7 - 8 раз лучше растворяется в липидной фазе, чем в воде и гидрофильных сайтах клетки. Существенная активация процесса образования свободных радикалов при химических воздействиях приводит к усилению перекисного окисления липидов и повреждению биологических мембран. Процесс перекисного окисления усиливается вторичным образованием из липидов высоко реакционно-способных и легко диффундирующих карбонильных радикалов, которые могут обусловливать неблагоприятные процессы, развивающиеся в клетках далеко за пределами сайта своего образования не только клетки, но и органа.
Не смотря на многочисленные исследования до настоящего времени нет четких представлений о значении активации перекисного окисления липидов для развития токсического процесса, инициируемого даже такими мощными прооксидантами, как паракват, адриамицин, нитрофурантион и т.д.
Для развития патологического процесса важно, чтобы окислительно-восстановительный цикл превращения ксенобиотика "работал" достаточно долго, с тем, чтобы произошло истощение механизмов антирадикальной защиты клетки (см. выше). Поскольку непродолжительная инициация окислительно-восстановительного цикла трансформации ксенобиотика может стимулировать систему антиокисдантной защиты, при интоксикациях некоторыми прооксидантами возможно развитие парадоксальной реакции, а именно - угнетение процесса окисления липидов в тканях.
Для развития процесса важна степень насыщенности тканей кислородом. В полностью аэробной среде образующийся из ксенобиотика восстановленный метаболит подвергается быстрому обратному окислению. При этом значительно возрастает количество радикалов в виде вторичных активных форм кислорода. Поэтому хорошо снабжаемые кровью и насыщенные кислородом ткани (легкие, сердце, головной мозг) являются более чувствительными к повреждающему действию прооксидантов.
4.2.3. Активация фосфолипаз
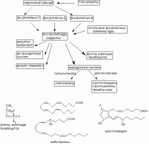
Важным механизмом повреждения биологических мембран является гидролиз фосфолипидов, наступающий вследствие активации фосфолипаз (особенно фосфолипазы A2). Активация энзима происходит в результате прямого или опосредованного (гипоксия, нарушение гомеостаза внутриклеточного кальция и т.д.) действия многих токсикантов на клетки организма (рисунок 16).
Результатом действия фосфолипазы А2 на липиды биологических мембран является высвобождение арахидоновой кислоты. Последняя является, в свою очередь, субстратом энзима циклооксигеназы. Превращение арахидоновой кислоты под влиянием энзима приводит к образованию эйкозаноидов (простагландинов, тромбоксанов, простациклинов) - веществ, активирующих воспалительные процессы в тканях. Под влиянием другого энзима, 5-липоксигеназы, арахидоновая кислота превращается в лейкотриены и эйкозатетраеноевые кислоты. Эти вещества являются химиоатрактантами нейтрофилов, веществами, регулирующими сосудистую проницаемость.
Еще одним продуктом энзиматического расщепления липидов мембран является фактор агрегации тромбоцитов (ФАТ) - клон биологически активных веществ (более 150 аналогов) близкого строения. ФАТ чрезвычайно токсичные вещества (LD50 для кролика - 0,005 мг/кг; для собаки - 0,07 мг/кг), вызывающие при внутривенном введении шокоподобное состояние (острый, некупируемый коллапс, бронхоспазм и др.).

|
 + Щелкните для загрузки увеличенной копии (8,23кб, 595x576 GIF) + Щелкните для загрузки увеличенной копии (8,23кб, 595x576 GIF)
|
| Рисунок 16. Образование биологически активных веществ при участии фосфолипаз, активируемых в ходе токсического процесса |

|
4.3. Биологические последствия действия токсикантов на мембраны
Вещества, действующие на клеточные мембраны, как правило, изменяют следующие их параметры:
1. Проницаемость. Изменяется поступление субстратов в клетки и отток продуктов метаболизма. Действие проявляется изменением интенсивности обмена веществ в клетке, нарушением электрических свойств мембран.
2. Электрический заряд. Нарушается раздражимость возбудимых клеток.
3. Структурная организация. Нарушается структура клетки, возможна клеточная гибель.
Кроме того, патохимические процессы, проходящие в мембране, приводят к образованию целого ряда биологически активных веществ (см. выше), участвующих в патогенезе токсического процесса.
Поскольку система внутриклеточных мембран также является мишенью для действия многочисленных токсикантов, среди них можно выделить группу митохондриальных ядов, повреждающих различные звенья процессов биоэнергетики, веществ действующих на шероховатый (нарушение процессов синтеза белка) и гладкий эндоплазматический ретикулум (индукция или угнетение метаболизма ксенобиотиков), лизосомальные мембраны (аутолиз клеток) и др.
5. Повреждение процессов синтеза белка и клеточного деления
Деление, рост, дифференциация клеток, их мутация и малигнизация - процессы, неразрывно связанные с обменом нуклеиновых кислот (ДНК и РНК) и синтезом белка. Эти процессы чрезвычайно сложны и включают множество этапов. Действие веществ, нарушающих нуклеиновый обмен и белковый синтез, в этой связи, весьма разнообразно (таблица 3). Подавляющее большинство механизмов токсического повреждения изучено в опытах in vitro на изолированных быстро размножающихся клетках, а порой даже на прокариотах. Вот почему среди приводимых в качестве примеров веществ, преобладают цитостатики, антибиотики и красители.
Таблица 3. Возможные точки приложения повреждающего действия токсикантов на процессы синтеза белка и нуклеиновых кислот.
| 1. Синтез ДНК. Репликация - изменение структуры (конформации) ДНК - нарушение процесса полимеризации ДНК - нарушение синтеза нуклеотидов - разрушение ДНК - нарушение процесса репарации ДНК - нарушение механизмов регуляции синтеза ДНК 2. Синтез РНК. Транскрипция - нарушение полимеризации РНК - нарушение процессии РНК - нарушение синтеза нуклеотидов - разрушение РНК - нарушение механизмов регуляции синтеза РНК 3. Синтез белка. Трансляция - нарушение организации и процессии рибосом и полисом - нарушение полимеризации аминокислот - нарушение образования аминоацетил-tРНК - нарушение формирования конформации белка и его третичной и четвертичной структур - нарушение механизмов регуляции трансляции |
5.1. Синтез ДНК. Репликация
Как указывалось ранее, нарушение репликации может явиться следствием химического взаимодействия ДНК с токсикантами. Однако возможны и иные механизмы повреждения (таблица 4).
Таблица 4. Механизмы действия ингибиторов синтеза нуклеиновых кислот и белков
| >Механизм действия | >Примеры |
| Ковалентное связывание с ДНК | иприт, циклофосфан |
| Индукция однонитевых разрывов | этиленоксид, этиленимин |
| Интеркалация | профлавин, этидиумбромид |
| Нековалентное связывание с ДНК | актиномицин |
| Взаимодействие с РНК-полимеразой | 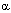 -аманитин -аманитин
|
| Взаимодействие с ревертазой | стрептоварицин |
| Взаимодействие с ДНК-полимеразой | эдеин, налидиксовая кислота |
| Влияние на синтез нуклеотдиов | фаллоидин, цитозин-арабинозид |
| Нарушение обмена фолиевой кислоты, пиримидина, пурина | аминоптерин, аминопурин, азогуанин, азоцитозин |
| Нгнетение образования аминоацетил-tРНК | 6-флюоротриптофан, триптазан, порвалин |
1. Угнетение активности ДНК-полимераз и других ферментов синтеза.
Эдеин и налидиксовая кислота угнетают активность ДНК-полимераз, а N-диметилрифампицин подавляет РНК-зависимый синтез ДНК (ингибитор ревертазы). Соединения, нарушающие конформацию ДНК, могут подавлять реакцию её полимеризации, не изменяя активность соответствующих энзимов.
2. Влияние на синтез дезоксирибонуклеотидов.
Элементарной единицей ДНК являются дезоксирибонуклеотидтрифосфаты. Их синтез осуществляется в организме и может быть прерван на различных этапах (синтез пуринов, пиримидинов, нуклеотидов). Вещества, нарушающие синтез нуклеотидов, называются антиметаболитами. В качестве антиметаболитов могут выступать различные аналоги естественных предшественников нуклеотидов, которые вытесняют их из связи с энзимами. Частично эти аналоги перерабатываются и встраиваются в структуру нуклеиновой кислоты (2-аминопурин, 5-флюороурацил), при этом нарушается строение и функция последней. Некоторые вещества (нуклеозидные антибиотики - кордицепин) блокируют встраивание дезоксирибонуклеотидов в молекулу ДНК.
3. Влияние на регуляцию синтеза ДНК.
В качестве регуляторов репликации, у эукариотов выступают цитоплазматические факторы - специальные белки, ответственные за процесс инициации. Их проникновение в ядро показано экспериментально. Определенную роль играют также гуморальные факторы роста, гормоны. Так, кортикоиды и глюкагон усиливают синтез ДНК.
4. Действие на разрушение ДНК и её репарацию.
Эндонуклеазы и лигазы - энзимы, участвующие в репарации мутированных или неправильно синтезированных молекул ДНК. Так, поврежденный нуклеотид может быть вырезан из молекулы ДНК (эндонуклеазы), а на его место встроен неповрежденный фрагмент (лигазы). Резкое повышение внутриклеточной концентрации Са2+, наблюдающееся при острой интоксикации некоторыми токсикантами (см. выше), сопровождается активацией эндонуклеаз и разрушением ДНК.
Ингибиторы лигаз угнетают процессы репарации ДНК и повышают частоту мутаций (например, бензамид и его производные).
5. Другие механизмы действия.
Помимо повреждения ДНК и ферментов, участвующих в её синтезе и репарации, существуют и другие способы токсического нарушения процесса репликации. Так, в фазе приготовления к митозу возможно повреждение центриолей и синтеза митотического аппарата, образующего клеточное веретено. Веретено формируется SH-содержащими протеинами, которые благодаря -S-S- связям образуют нитевидные структуры. Естественно, токсиканты, взаимодействующие с SH-группами способны повреждать митотические веретена. Примерами таких токсикантов являются мышьяк, ртуть и их соединения, колхицин, подофилотоксин и др.
5.2. Синтез РНК. Транскрипция
В клетках определяются несколько форм РНК. Особое функциональное значение имеют: м-РНК, как матрица для синтеза полипептидов, t-РНК - молекула-переносчик аминокислот на рибосомы для их последующей полимеризации, r-РНК - составная часть рибосом. Возможны следующие механизмы повреждения РНК:
1. Нарушение конформации и свойств ДНК (см. выше).
На поврежденной ДНК синтезируется измененные молекулы РНК, не свойственные организму.
2. Угнетение активности РНК-полимераз.
Ингибитором РНК-полимеразы является, в частности, аманитин - яд бледной поганки.
3. Влияние на РНК-процессинг.
Это явление изучено недостаточно. Полагают, что кордицепин (см. выше) ингибирует начало процесса синтеза РНК.
4. Угнетение синтеза нуклеотидов.
Как уже указывалось, целый ряд веществ, так называемых антиметаболитов, способен угнетать синтез пуриновых и пиримидиновых оснований и нуклеотидов. Такие вещества, прежде всего, нарушают обмен РНК, находящихся в состоянии активного обращения. Возможно извращение синтеза РНК вследствие встраивания в молекулу "ложных" нуклеотидов (5-бромурацил, 8-азагуанин).
5. Нарушение регуляции синтеза РНК.
Синтез РНК контролируется целым рядом факторов. Большая часть генома находится в репримированном состоянии, т.е. блокирована специальными белками (гистонами) и не участвует в процессе транскрипции. Активация этих отрезков молекулы ДНК осуществляется низкомолекулярными хромосомными РНК, цитоплазматическими протеинами и другими факторами (например гормонами). Так, стероиды (эстрогены, андрогены, кортикостероиды) стимулируют синтез РНК и, следовательно, белка. Аналогичные эффекты описаны для инсулина и глюкагона. Многочисленные синтетические соединения (барбитураты, толбутамид, бензпирен, метилхолентрен, диоксин и т.д.) вызывают индукцию синтеза микросомальных энзимов, ответственных за метаболизм ксенобиотиков. По всей видимости, они взаимодействуют с репрессорными протеинами, вызывают депримирование ДНК и активируют тем самым синтез РНК и соответствующих белков.
5.3. Синтез белков. Трансляция
Объединение аминокислот в полипептидную цепь осуществляется на рибосомах или полисомах. Токсиканты могут вмешиваться в процессы синтеза белка и на этом этапе. Возможны следующие механизмы токсического действия:
1. Нарушение конформации рибосом и организации полисом.
Этот механизм экспериментально показан для целого ряда антибиотиков, действующих на рибосомы и полисомы бактериальных клеток.
2. Угнетение процесса образования полипептидной цепи.
Многие антибиотики вмешиваются в процесс синтеза белка на рибосомах бактерий. При этом выявляются нарушения:
- процессов считывания информации с кода мРНК;
- образования формилметионил-tРНК и повреждение тем самым инициации синтеза полипептидной цепи;
- образования пептидных связей (таков, в частности, один из механизмов токсического действия дифтирийного токсина);
- затруднение транслокации пептидил-tРНК и мРНК.
3. Угнетение синтеза и формирования аминоацил-tРНК.
Необходимым этапом полимеризации аминокислот и образования полипептидной цепи является их активация, путем образования комплекса с tРНК (образование аминоацил-tРНК). На первом этапе происходит взаимодействие аминокислот с АМФ (активация), и лишь затем образуется связь с РНК. Введение в среду, где инкубируется экспериментальный материал (делящиеся клетки, бактерии), ненормальных аминокислот, например D-форм или таких как этионин, тиенилаланин, алкилвалин и др., приводит к угнетению активности синтезирующих энзимов, а следовательно и процесса синтеза белка в целом.
4. Нарушение конформации синтезируемой белковой молекулы.
Синтезированная полипептидная цепь спонтанно формирует свою третичную структуру. Отчасти процесс проходит при участии различных кофакторов. Угнетение синтеза таких кофакторов или поступление в организм их неактивных аналогов (антивитаминов) нарушает процесс.
5. Влияние на регуляцию процесса трансляции.
Имеются данные о том, что процесс трансляции, особенно его инициация и терминация, подлежат контролю. Отвечают за это особые виды регуляторных РНК и протеинов, а также механизмы контролирующие уровень цАМФ в клетках. Образованию полисом способствует повышение содержания эстрадиола; инсулин активирует процесс инициации синтеза белка на малых субъединицах рибосом. Витамин К блокирует на уровне трансляции образование протромбина и других факторов свертывания крови и т.д. Усиление или угнетение рассмотренных процессов может лежать в основе токсического действия некоторых веществ.
5.4. Биологические последствия действия токсикантов на нуклеиновый обмен и синтез белка
Дата публикования: 2014-11-04; Прочитано: 253 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
