 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Раздел 2. Токсикодинамика 3 страница
|
|
1.2. Механизмы токсического повреждения систем энергообеспечения клетки
Нарушение процессов биоэнергетики приводит к повреждению биологических систем, вплоть до их гибели. Токсиканты могут влиять на энергетические процессы различными способами. Некоторые примеры представлены на рисунке 2.
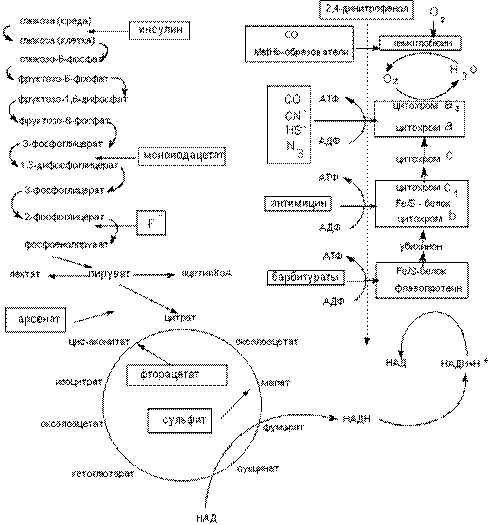
Рисунок 2. Механизмы действия токсикантов на биоэнергетические процессы
Мышьяк, ртуть, их органические и неорганические соединения, другие тяжелые металлы, иодацетат и проч., могут взаимодействовать с сульфгидрильными группами целого ряда энзимов гликолиза и цикла трикарбоновых кислот и подавлять их активность (сульфгидрильные яды). Достаточно избирательно действуют вещества-аналоги природных субстратов (фторацетат, оксид углерода и т.д.). Они взаимодействуют с активными центрами соответствующих энзимов, угнетая отдельные этапы процесса энергообеспечения клеток.
Ингибирование энзимов цикла трикарбоновых кислот (ТК) является пагубным для клетки. Так, некоторые фторированные спирты и фторкарбоновые кислоты (ингибиторы ферментов цикла ТК), являются чрезвычайно токсичными соединениями, вызывающими смертельное отравление в дозах нескольких миллиграмм на килограмм массы.
Большое токсикологическое значение имеют вещества, действующие на цепь дыхательных ферментов. Токсиканты, блокирующие элементы цепи дыхательных ферментов (цианиды, сульфиды), могут в течение нескольких минут привести организм к гибели. Первая ступень цепи дыхательных ферментов чувствительна к седативным средствам (барбитураты).
Некоторые вещества способны разобщать процессы биологического окисления и фосфорилирования. Такими свойствами обладают, как правило, липофильные соединения, содержащие фенольную группировку в молекуле и являющиеся слабыми органическими кислотами: 2,4-динитрофенол (ДНФ), динитро-о-крезол, хлорфенолы, дикумарол, а также салицилаты, арсенаты, тироксин и др. (рисунок 3). Самым активным разобщителем является 3,5-дитретбутил-4-гидроксибензилиден-малононитрил (SКF6847). Это вещество примерно в 1800 раз активнее 2,4-ДНФ и уже в концентрации 0,2 моль на 1 моль цитохрома вызывает максимальное разобщение.
in vitro "разобщители" стимулируют скорость потребления кислорода митохондриями и индуцируют активность АТФазы. in vivo в результате их действия значительно активируются процесс клеточного дыхания, однако содержание АТФ в клетках при этом снижается. Образующаяся в ходе окисления субстратов энергия рассеивается в форме тепла, температура тела отравленного резко повышается, учащается дыхание, появляются тошнота, обильное выделение пота, развивается острая сердечная недостаточность, кома. Интоксикация развивается бурно и заканчивается быстрой гибелью пострадавшего.
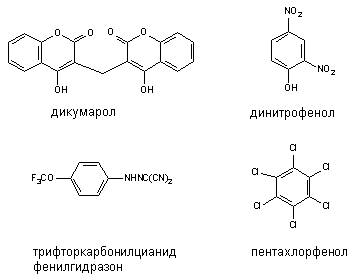
Рисунок 3. Структура некоторых разобщителей процесса окислительного фосфорилирования
Механизм действия разобщителей до конца не выяснен. Полагают, что они облегчают переход протонов непосредственно через мембрану из митохондрий в цитоплазму. Двигателем же процесса образования АТФ из АДФ и неорганического фосфата как раз и является градиент протонов по обе стороны мембраны митохондрий, не проницаемой для Н+, поддерживаемый реакциями биологического окисления.
Наконец еще одним механизмом нарушения энергообеспечения клетки является угнетение митохондриальной транслоказы, обеспечивающей транспорт ситезированной АТФ из митохондрий в цитоплазму. Таким образом, действует, в частности атрактилозид, вещество выделяемое из растения Distel Atractylis gummifera, произрастающего в Среднеземноморье (рисунок 4).
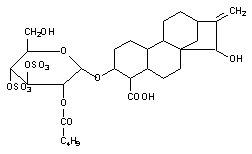
Рисунок 4. Структура атрактилозида
Непрямым механизмом цитотоксического действия является понижение токсикантами парциального давления кислорода в тканях.
Нехватку кислорода человек и другие млекопитающие могут переносить только несколько минут. Особенно чувствительными к аноксии являются клетки органов с интенсивным энергообменом (таблица 1).
Таблица 1. Потребление кислорода различными органами крысы
| >Орган | >Скорость потребления О2 (мл/г ткани мин) |
| Скелетная мускулатура | >0,875 |
| Кожа | >0,416 |
| Кости | >0,153 |
| Кровь | >0,025 |
| Печень | >2,010 |
| Почки | >1,840 |
| Мозг | >4,120 |
| Легкие | >1,250 |
| Сердце | >1,930 |
(Field et al., 1939)
Высоко чувствителен к нарушению процессов клеточного дыхания головной мозг. Если периферические ткани способны переживать (хотя и с нарушениями функций) частичную нехватку кислорода в течение нескольких часов, то необратимые изменения в ЦНС наступают спустя 4 - 5 минут после полного прекращения снабжения нейронов кислородом. Поэтому токсиканты, нарушающие кислородтранспортные функции крови также весьма токсичны (оксид углерода, нитро-, аминосоединения и пр.). Оксид углерода связывается с двухвалентным железом гема с образованием карбоксигемоглобина, метгемоглобионообразователи переводят железо гема из двухвалентной в трехвалентную форму. В обоих случаях гемоглобин утрачивает способность связывать кислород в легких и транспортировать его в ткани.
2. Нарушение гомеостаза внутриклеточного кальция
Роль кальция, как регулятора физиологических процессов, протекающих в клетке, хорошо известна. Нарушение внутриклеточного гомеостаза этого иона, сопровождающееся существенным повышением его концентрации в цитоплазме клетки, лежит, как полагают, в основе механизма клеточной гибели при целом ряде патологических состояний таких как ишемия, аутоиммунные процессы и т.д. Цитотоксическое действие самых разных токсикантов (цианидов, четыреххлористого углерода, свинца, метилртути, хлордекона, оловоорганических соединений, алкилирующих агентов, диоксина и т.д.) также полагают, хотя бы отчасти, связано с повышением уровня кальция внутри клеток.
В норме низкая концентрация кальция в цитоплазме поддерживается механизмами его активного транспорта через биомембраны и системой его компартментализации (накопление в клеточных органеллах) (рисунок 5).
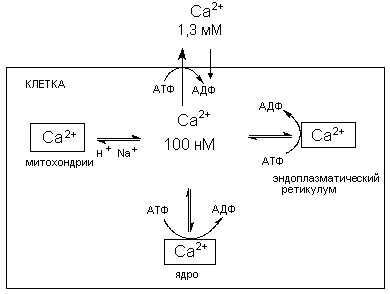
Рисунок 5. Схема регуляции содержания ионов кальция в цитоплазме.
Обычно поступление Са2+ в клетку по градиенту концентрации уравновешивается его активным выведением, осуществляемым при участии Са2+-транспортной АТФазы в печени и эритроцитах и Na+/Ca2+ обменом в возбудимых тканях. Кроме того, уровень кальция регулируется его секвенированием в клеточных органелдах (ядре, митохондриях, эндоплазматическом ретикулуме), а также связыванием внутриклеточными белками.
Нарушение механизмов поддержания гомеостаза внутриклеточного кальция, как это видно из представленной схемы обмена иона, может стать следствием:
- повреждения биологических мембран и усиления их проницаемости для ионов;
- нарушения биоэнергетики клетки, приводящие к истощению запасов макроэрогов;
- изменения функционального состояния белковых комплексов (в том числе путем действия на соответствующие рецепторы), образующих каналы для Са2+.
Все эти механизмы могут приводить к усилению инфлюкса кальция из внеклеточной жидкости и его высвобождению из депо в цитоплазму клетки. Примеры веществ, повреждающих механизмы поддержания гомеостаза кальция внутри клеток, представлены в таблице 2.
Таблица 2. Некоторые вещества, нарушающие распределение кальция внутри клетки
| 1. Высвобождение кальция из митохондрий: - динитрофенол - динитрокрезол - хиноны - перекиси - аллоксан - железо - кадмий | 3. Усиление поступление кальция через плазматическую мембрану: - четыреххлористый углерод - диметилнитрозамин - парацетамол - 2,3,7,8-тетрахлордибензо-п-диоксин |
| 2. Высвобождение кальция из эндоплазматического ретикулума: - четыреххлористый углерод - бромбензол - хиноны - перекиси - альдегиды | 4. Угнетение эффлюкса кальция из клетки: - цистамин - хиноны - перекиси - дикват - ванадий |
Цитотоксический эффект в результате стойкого повышения содержания кальция в цитоплазме в настоящее время связывают с развивающимся при этом повреждением целостности цитоскелета и неконтролируемой активацией катаболических энзимов (фосфолипаз, протеаз, эндонуклеаз).
2.1. Повреждение цитоскелета
Цитоплазма клетки помимо цитозоля и клеточных органелл, как правило, содержит еще и нитевидные белковые структуры, которые в массе формируют клеточный скелет. Это образование выполняет не только стабилизирующую и структурирующую, но и другие функции, среди которых обеспечение клеточного деления, внутриклеточный транспорт, секреция, обмен рецепторных белков, регуляция клеточной подвижности и формы. Белки цитоскелета эпителиальных клеток формируют филаменты кератина, в мышечных клетках - десмин или волокна актина и миозина, в соединительнотканных клетках - виментин, в эритроцитах - спектрин, в нервных и глиальных клетках - нейро- и глиофиламенты. Важную роль в физиологии клеток играют микротрубочки, образованные молекулами тубулина, организованные в характерные нитевидные структуры. Они принимают участие в формировании митотического веретена делящихся клеток.
Велика роль структур, формирующих цитоскелет в нервных клетках. Здесь микрофиламенты и микротрубочки принимают участие в монтаже системы антероградного и ретроградного аксонального транспорта биологически активных веществ. Как известно белки синтезируются в перикарионе нейрона, а затем транспортируются с помощью этой системы на периферию клетки (в область синаптических контактов). Транспорт по аксону необходим и для обеспечения функций аксональных мембран: оборот глобулярных протеинов в мембране аксонов, выполняющих функции ионных каналов (см. выше). Состояние Швановских клеток также контролируется трофическими веществами, переносимыми с аксональным током. С аксональным током перемещается весь набор энзимов, нейромедиаторов и их предшественников, необходимых для обеспечения синаптической передачи нервных импульсов.
При действии разнообразных веществ на изолированные клетки (культура ткани) выявляется отчетливое изменение формы их поверхности: появляются выпячивания цитоплазмы, называемые пузырьками (blebs). Такое "пузырение" (или вскипание - blebbing) клеточной мембраны - один из ранних и надежных признаков разрушения сети цитоскелета. Вещества, нарушающие гомеостаз внутриклеточного кальция, инициируют "вскипание" мембраны. Механизм феномена объясняют следующим образом. Кальций вовлечен в процесс поддержания структуры цитоскелета как непосредственно, так и через ряд Са2+-связывающих протеинов и Са2+-зависимых энзимов. Особенно значим уровень Са2+ в цитоплазме для образования ассоциации белков цитоскелета с белками плазматической мембраны и взаимодействия различных элементов цитоскелета. Стойкое увеличение концентрации кальция в цитозоле по-видимому вызывает отщепление актина микрофиламентов от 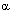 -актинина, белка, служащего промежуточным звеном, связывающим микрофиламенты цитосклета с белками плазматической мембраны. Кроме того Са2+ активирует протеазы (см. ниже), которые могут расщеплять актин-связывающие белки, разрушая тем самым места прикрепления филаментов цитоскелета к клеточной мембране. Отщепление цитоскелета от мембраны приводит к ослаблению фиксации последней и её "вскипанию", что и наблюдается при действии на клетки различных токсикантов (рисунок 6). Вещества, связывающие внутриклеточный кальций, и ингибиторы Са2+-зависимых протеаз препятствуют "вскипанию" плазматической мембраны клеток, обработанных токсикантами. Другой механизм изменения конфигурации плазматической мембраны под влиянием избыточной концентрации кальция, может состоять в истощении внутриклеточных запасов макроэргов.
-актинина, белка, служащего промежуточным звеном, связывающим микрофиламенты цитосклета с белками плазматической мембраны. Кроме того Са2+ активирует протеазы (см. ниже), которые могут расщеплять актин-связывающие белки, разрушая тем самым места прикрепления филаментов цитоскелета к клеточной мембране. Отщепление цитоскелета от мембраны приводит к ослаблению фиксации последней и её "вскипанию", что и наблюдается при действии на клетки различных токсикантов (рисунок 6). Вещества, связывающие внутриклеточный кальций, и ингибиторы Са2+-зависимых протеаз препятствуют "вскипанию" плазматической мембраны клеток, обработанных токсикантами. Другой механизм изменения конфигурации плазматической мембраны под влиянием избыточной концентрации кальция, может состоять в истощении внутриклеточных запасов макроэргов.
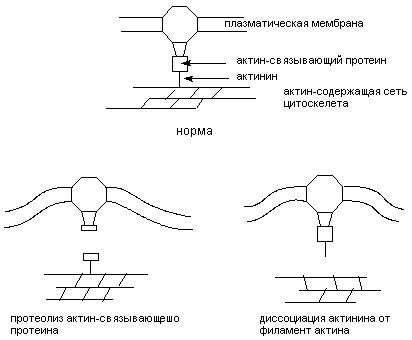
Рисунок 6. Са2+-зависимые механизмы повреждения цитоскелета клеток, обработанных хинонами
Белки цитоскелета повреждаются не только в результате повышения содержания Са2+ в цитоплазме, но и в результате воздействия токсикантов с иными механизмами токсического действия. Так, непосредственно взаимодействуют с белками цитохалазины, фаллоидин (один из токсинов бледной поганки), а также колхицин (рисунок 7), алкалоиды барвинка (винбластин, винкристин).
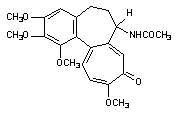
Рисунок 7. Структура колхицина
Действие веществ на тубулин митотического веретена делящихся клеток приводит к нарушению пролиферации последних (особенно клеток системы крови). Колхицин и алкалоиды барвинка в эксперименте, разрушая цитоскелет аксонов нервных клеток, существенно нарушают аксональный ток. Вероятно, аналогичные эффекты могут развиваться и при повреждении цитоскелета веществами, нарушающими внутриклеточный гомеостаз кальция.
2.2. Активация фосфолипаз
Фосфолипазы катализируют гидролиз фосфолипидов, входящих в состав клеточных мембран. Эти энзимы широко представлены в различных клетках. Особое внимание исследователи уделяют фосфолипазам А2 - группе липаз, основная функция которых состоит в удалении из мембраны поврежденных фосфолипидов, путем высвобождения жирных кислот, подвергшихся пероксидации. Фосфолипазы А2 являются Ca2+- и кальмодулин-зависимыми энзимами, и, следовательно, чувствительными к повышению кальция в цитоплазме. Стимуляция фосфолипазы кальцием приводит к усилению разрушения фосфолипидов мембран и повреждению клеток. Повышение содержания кальция в цитоплазме, активацию фосфолипазы, ускорение оборота фосфолипидов с последующей гибелью гепатоцитов регистрировали при токсическом поражении печени четыреххлористым углеродом. Аналогичные изменения наблюдали в миокардиоцитах и гепатоцитах, инкубируемых в условиях аноксии. Хлорпромазин, угнетающий активность фосфолипаз, защищает клетки от повреждающего действия циототоксикантов, нарушающих внутриклеточный гомеостаз кальция. Эти и другие данные подтверждают значение рассматриваемого механизма в развитии токсического повреждения клеток.
2.3. Активация протеаз
К числу протеаз, с оптимумом активности в области нейтральных значений рН, относятся: АТФ-зависимые, убиквитин-зависимые, Са2+_зависимые (кальпаины) протеазы. Кальпаины присутствуют практически во всех клетках млекопитающих. Они локализуются вне лизосом, в мембранных структурах в форме неактивного комплекса с ингибиторными протеинами (кальпастатины). Основные функции кальпаинов - репарация цитоскелета и клеточных мембран, разрушение рецепторных протеинов и их обновление, активация некоторых энзимов, участие в процессах митоза.
Идентифицированы две изоформы энзимов - с высоким и низким сродством к кальцию, обе активируемые этим ионом. В эксперименте показано, что стойкая, неуправляемая активация кальпаинов кальцием приводит к повреждению микрофиламентов цитоскелета тромбоцитов, клеточных мембран эритроцитов, гибели клеток печени, миокардиоцитов и т.д.
2.4. Активация эндонуклеаз
При завершении клеткой жизненного цикла активируется процесс "программированной" физиологической клеточной гибели - апоптоз. На ранних этапах в апаптотической клетке проявляются морфологические изменения: "вскипание" клеточной и ядерной мембран, конденсация хроматина. Самым надежным маркером развивающегося процесса является активация эндонуклеаз, энзимов, расщепляющих хроматин на фрагменты - олигонуклеосомы. Активация эндонуклеаз отмечается при гибели тимоцитов и лимфоцитов в облученном организме.
Установлено, что кальций участвует в активации эндонуклеаз. Вызванная глюкокортикоидами фрагментация ДНК тимоцитов и гибель этих клеток связаны со стойким повышением содержания Са2+ в цитоплазме. Одним из постоянных проявлений отравления экспериментальных животных диоксином является атрофия тимуса. Установлено, что при этом в тимоцитах значительно активируется процесс фрагментации ДНК, причем периоду разрушения хроматина предшествует период повышения концентрации кальция в цитоплазме. Возможно, что механизм цитотоксичности ТХДД хотя бы отчасти связан с кальциевой активацией эндонуклеаз.
Активация эндонуклеаз может быть причиной гибели клеток печени, миокарда, почек при отравлениях многими химическими веществами.
3. Активация свободно-радикальных процессов в клетке
3.1. Сущность явления
Многие ксенобиотики, попав во внутренние среды организма, подвергаются метаболическим превращениям (см. раздел "Биотрансформация ксенобиотиков в организме"). Одним из возможных результатов метаболизма является образование реактивных промежуточных продуктов. Взаимодействие этих реактивных метаболитов, либо вторичных продуктов их превращения, с молекулами-мишенями приводит к нарушению клеточных функций. Изменения в клетках могут быть следствием как избирательного повреждения какой либо одной биохимической структуры, так и сочетанного повреждения нескольких структурно-функциональных элементов. Достаточно часто в ходе исследований удается идентифицировать реактивный метаболит, изучить особенности его взаимодействия с молекулами-мишенями, оценить факторы облегчающие и модулирующие эти взаимодействия. Становиться все более очевидным, что многие реактивные промежуточные продукты метаболизма ксенобиотиков появляются в форме свободных радикалов, т.е. на внешней орбитали молекулы метаболита находится неспаренный электрон. Центром образования такого радикала в молекуле могут быть атомы углерода, азота, кислорода, серы (рисунок 8):
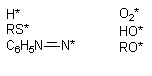
Рисунок 8. Примеры простых свободных радикалов
Хорошо доказана возможность образования радикалов при метаболизме ацетаминофена, адриамицина (и других цитостатиков антрациклиновой группы), нитрофурантиона, параквата, фенилгидразина, четыреххлористого углерода, бенз(а)пирена и т.д. (рис. 9).
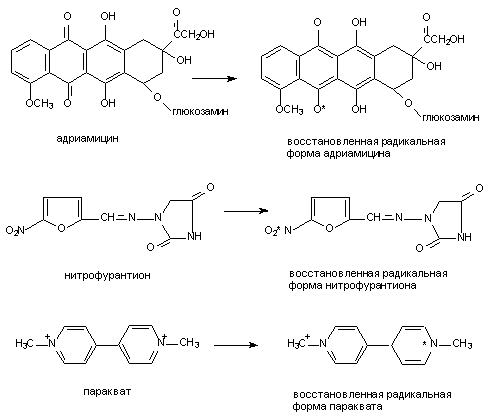
Рисунок 9. Структура веществ, подвергающихся биотрансформации с образованием активных радикалов
Появление неспаренного электрона на внешней орбитали делает метаболит чрезвычайно реакционноспособным. Активные радикалы вступают внутри клетки в многочисленные реакции, в том числе, связываются с ненасыщенными жирными кислотами, отщепляют водород от других молекул, взаимодействуют друг с другом с образованием димеров и т.д.
Свободные радикалы, такие как анионы семихинонов, азо-анионы, анионы нитроароматических соединенй, биспиридиниевые катионы, могут активировать молекулярный кислород путем одновалентного восстановления последнего до супероксид-аниона (О2-*). Супероксид при взаимодействии с водой с большой скоростью дисмутирует с образованием перекиси водорода (Н2О2) и чрезвычайно активного оксиданта - гидроксильного радикала (*ОН). Некоторые металлы с переменной валентностью (медь, железо) способны катализировать в организме реакции такого типа. Эти, так называемые, вторичные радикалы представляют высокую опасность для клетки. Обладая достаточной стабильностью, они взаимодействуют с самыми разными биомолекулами, и не только повреждают их, но и провоцируют цепные реакции дальнейшего образования активных радикалов из липидов, аминокислот, нуклеиновых кислот и т.д. Интегральный эффект такого каскада радикал-инициирующих реакций приводит к значительному нарушению физиологии клетки, её повреждению. На макроскопическом уровне это проявляется некрозом ткани, развитием фиброза в пораженных органах, а в отдаленный период - появлением новообразований (рисунок 10).

|
 + Щелкните для загрузки увеличенной копии (9,25кб, 576x538 GIF) + Щелкните для загрузки увеличенной копии (9,25кб, 576x538 GIF)
|

|
Рисунок 10. Активация свободно-радикальных процессов в клетках и их последствия
3.2. Механизмы клеточной антирадикальной защиты
Свободные активные радикалы в норме в клетке образуются постоянно. Так, в процессе метаболизма веществ в гладком эндоплазматическом ретикулуме флавопротеины, а в митохондриях окислительные энзимы цепи дыхательных ферментов, постоянно продуцируют некоторое количество супероксид-иона (О2-*) и перекиси водорода (Н2О2). Однако содержание в клетке этих и других радикалов жестко контролируются широким спектром биохимических инструментов антирадикальной защиты, включая супероксиддисмутазу, каталазу, GSH-пероксидазу, GSSG-редуктазу, 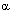 -токоферол,
-токоферол, 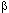 -каротин, аскорбиновую кислоту, восстановленный глутатион, мочевую кислоту. Отдельные элементы системы защиты действуют комплексно и потенцируют эффект друг друга. Они локализуются либо в гидрофобных, либо гидрофильных компартментах клеток (например, токоферол - липофилен, глутатион - гидрофилен).
-каротин, аскорбиновую кислоту, восстановленный глутатион, мочевую кислоту. Отдельные элементы системы защиты действуют комплексно и потенцируют эффект друг друга. Они локализуются либо в гидрофобных, либо гидрофильных компартментах клеток (например, токоферол - липофилен, глутатион - гидрофилен).
Механизмы антирадикальной защиты включают как ферментативные, так и неферментативные процессы. Самым простым примером некаталитического разрушения радикалов является их гидролиз, лежащий в основе нейтрализации многих водорастворимых продуктов, например, ацилгалидов, эпоксидов, карбокатионов, изоцианатов, эписульфониум-иона и т.д.
Наиболее важной неферментативной реакцией "обезвреживания" радикалов является их взаимодействие с биологическими антиоксидантами, такими как витамин Е, глутатион, витамин С. В результате такого взаимодействия образуются нереакционноспособные вещества, прерывание каскад "наработки" свободных радикалов.
Гомеостаз в клетке поддерживается за счет равенства скоростей образования и связывания радикалов. В случае повреждения механизмов защиты клеток, либо активации процессов образования радикалов, превосходящих по интенсивности возможности защиты, или даже разрушающих эти механизмы, развивается поражение клетки. Так, интоксикация преимущественным пульмонотоксикантом паракватом приводит к некоторому снижению содержания глутатиона в печени. Предварительное связывание глутатиона диэтилмалеатом приводит к тому, что паракват приобретает свойства преимущественного гепатотоксиканта. Таким образом, резерв глутатиона в клетке имеет особое значение для обеспечения её антиоксидантной защиты.
Хотя глутатион может взаимодействовать с многочисленными субстратами и неферментативно, наличие в тканях энзима глутатион-S-трансферазы (GST) значительно ускоряет течение процесса, повышает его эффективность. Множественность форм GST, их широкая субстратная специфичность, высокий уровень активности в различных тканях делают систему глутатионтрансфераз наиболее универсальной и значимой для связывания активных метаболитов.
Глутатион и селен-зависимые глутатионпероксидазы восстанавливают перекись водорода и другие гидроперекиси до менее токсичных алкоголей и воды. Глутатион-дисульфид, образующийся в ходе этой реакции, подвергается обратному восстановлению до глутатиона с помощью НАДФН-зависимой глутатионредуктазы. Активность глутатионредуктазы ингибируют изоцианат-содержащие продукты метаболизма нитрозомочевины.
Два других энзима, имеющих большое значение для детоксикации свободных радикалов, это супероксиддисмутаза (СОД) и каталаза. Первый из энзимов катализирует преобразование двух супероксидных радикалов в молекулу кислорода и перекись водорода. Обнаруживаемая во всех тканях СОД содержит в структуре активного центра ионы Cu, Zn, Mn. Образующаяся перекись водорода разрушается с помощью каталазы или глутатионпероксидазного цикла.
3.3. Механизмы активации ксенобиотиков и образования свободных радикалов
Ксенобиотики могут трансформироваться в радикалы как энзиматическим, так и неэнзиматическим путем. Например известны токсиканты, специфично повреждающие тела дофаминэргических и серотонинэргических нейронов ЦНС (6-гидроксидофамин и 5,7-дигидрокситриптпмин), 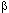 -клетки поджелудочной железы (аллоксан) и др., легко подвергающиеся аутоокислению с образованием активных радикалов (рисунок 11). Параллельно с самоокислением молекулы подобных ксенобиотиков осуществляется продукция реактивных форм кислорода.
-клетки поджелудочной железы (аллоксан) и др., легко подвергающиеся аутоокислению с образованием активных радикалов (рисунок 11). Параллельно с самоокислением молекулы подобных ксенобиотиков осуществляется продукция реактивных форм кислорода.
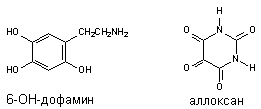
Рисунок 11. Вещества, инициирующие свободно-радикальные процессы путем спонтанного окислительно-восстановительного превращения молекулы в клетках
Ионы металлов с переменной валентностью (медь, железо) облегчают процесс аутоокисления, а восстановители, например аскорбиновая кислота, обеспечивают регенерацию исходной формы ксенобиотика. Таким образом, формируется неэнзиматический окислительно-восстановительный цикл токсиканта. SH-соединения, никотиновая кислота в опытах in vitro останавливают процесс.
Ультрафиолетовые лучи активируют превращение (фотоактивация) накапливающихся в коже сульфаниламидных препаратов, 4-аминобензойной кислоты (рисунок 12) и др. в свободно-радикальную форму, которая, как полагают, ответственна за развитие фототоксических и фотоаллергических процессов у лиц, принимающих эти лекарства.

Рисунок 12. Структура о-аминобензойной (антраниловой) кислоты
При лечении псориаза псораленом и его аналогами одновременно назначаемое длинноволновое ультрафиолетовое облучение (320 - 400 нм) кожи пациентов активирует превращение препаратов в свободно-радикальную форму. Активные радикалы повреждают измененные эпидермальные клетки, образуя фотоаддукты с пиримидиновыми основаниями их ДНК. Наступает ремиссия болезни, но побочным неблагоприятным эффектом является развитие в последующем меланом и сквамозноклеточной карциномы, так как в процессе лечения изменяется генетический код и некоторой части здоровых эпидермоцитов.

|
 + Щелкните для загрузки увеличенной копии (5,08кб, 604x270 GIF) + Щелкните для загрузки увеличенной копии (5,08кб, 604x270 GIF)
|
| Рисунок 13. Окислительно-восстановительный цикл трансформации ксенобиотиков, сопровождающийся активацией свободно-радикальных процессов в клетке. О2* - супероксидный анион; *ОН - гидроксильный радикал |

|
Однако основной путь образования свободных радикалов в клетке - энзиматический метаболизм ксенобиотиков (рисунок 13). Способность веществ метаболизировать с образованием радикалов обычно связывают с величиной их одноэлектронного восстановительного потенциала. Соединения с высоким сродством к электронам предрасположены к их акцепции и легко восстанавливаются биологическими системами, в то время как вещества с низким сродством к электрону восстанавливаются биосистемами плохо. Вещества, не вступающие в окислительно-восстановительный цикл не являются источниками образования свободных радикалов в клетках. Например, хлороформ (НССl3) является слабым источником прооксидантных процессов из-за низкой способности к оденоэлектронному восстановлению. Напротив, четыреххлористый углерод (CCl4) легко метаболизирует в трихлорметильный радикал (*ССl3), способный отнимать водородные атомы от ненасыщенных жирных кислот, и является инициатором перекисного окисления липидов. Кроме того *CCl3 связывается с липидами микросомальных мембран, активирует кислород, который в свою очередь взаимодействует с макромолекулами (белками, нуклеиновыми кислотами). Восстановление четырёххлористого углерода до трихлорметилового радикала катализируется комплексом оксидаз смешанной функции, состоящим из флавопротеинов, НАДФН-зависимой Р-450 релуктазы, НАДН-цитохром b5 редуктазы и оксидазы цитохрома Р-450.
В процессе метаболизма адриамицина, митомицина С, нитрофурантиона, параквата и некоторых других ксенобиотиков образование промежуточных свободных радикалов идет при участии одной лишь НАДФН-зависимой цитохром Р-450-редуктазы. При этом образовавшиеся радикалы удается выявить только в жестких анаэробных условиях. В присутствии кислорода восстановленные радикалы быстро окисляются до исходной формы, при этом электроны переходят с радикала на молекулу кислорода, что приводит к образованию супероксидного аниона и других его реактивных форм и также активации свободно-радикальных процессов.
Дата публикования: 2014-11-04; Прочитано: 501 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
