 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Направление окислительно-восстановительных реакций
|
|
Опыт №8. Влияние характера среды на протекание окислительно-восстановительных реакций
В три пробирки налить по 1–2 мл раствора КМnO4, затем прибавить: в первую – 5 капель разбавленной серной кислоты, во вторую – 5 капель дистиллированной воды, в третью – 5 капель концентрированного раствора щёлочи. После этого в каждую из пробирок прибавить шпателем одинаковое количество сухой соли Na2SO3. Встряхиванием раствора добиться изменения окраски в каждой из пробирок. Составить уравнение реакций на основе электронного баланса, имея ввиду следующее:
а) во всех трёх случаях ион 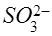 переходит в ион
переходит в ион  , причём оба иона являются бесцветными и на окраску раствора не влияют;
, причём оба иона являются бесцветными и на окраску раствора не влияют;
б) в кислой среде ион МnО-4 переходит в ион Мn2+
в) в нейтральной среде ион МnО  восстанавливается до МnО2;
восстанавливается до МnО2;
г) в щелочной среде образуется ион  , который окрашивает раствор в зелёный цвет.
, который окрашивает раствор в зелёный цвет.
Опыт №9. Влияние кислотности среды на направление реакции взаимодействия йода с щёлочью
Кристаллик йода обработать в пробирке небольшим количеством раствора щёлочи при слабом нагревании. Наблюдать переход йода в раствор. Составить уравнение реакции, имея в виду, что одним из продуктов реакции является йодат щелочного металла.
Полученный раствор подкислить разбавленной серной кислотой. Наблюдать выделение свободного иода. Составить уравнения реакции взаимодействия иодида и иодата в присутствии. Н2SO4. Объяснить, почему реакция пошла в обратном направлении.
Контрольные вопросы
1. Какие вещества могут быть:
а) только окислителями;
б) только восстановителями;
в) одновременно и окислителями и восстановителями? От чего это зависит?
2. Чем объяснить двойственность свойств пероксида водорода в окислительно-восстановительных реакциях?
3. Какие известны типы окислительно-восстановительных реакций?
4. Чем отличаются реакции межмолекулярного от реакций внутримолекулярного окисления-восстановления?
5. Привести 3 пары веществ, которые могут реагировать между собой по типу реакций окисления-восстановления с участием атомов одного и того же элемента в разных степенях окисления?
6.Какие из перечисленных веществ могут подвергаться диспропорционированию: КС1; NaNO2; CuSO4; I2; SO2; K2CrO4?
7. В какой среде КМnO4 является более сильным окислителем?
8. Почему изменением рН раствора можно добиться протекания окислительно-восстановительной реакции в обратном направлении?
9. Какой фундаментальный закон природы лежит в основе составления уравнений окислительно-восстановительных реакций методом электронно- ионного баланса?
Лабораторная работа № 11
Дата публикования: 2014-11-04; Прочитано: 271 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
