 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Перший закон термодинаміки. Теплоємність газів. 4 страница
|
|
Відповідь: 1а) р=2,87∙106 Па; 1б) р=2,73∙108 Па; 2а) р=3,09∙106 Па; 2б) р=6,18∙107 Па.
5.479. В закритій судині об'ємом V = 0,5 м3 знаходиться 0,6 кмоля вуглекислого гази при тиску 3∙106 Па, Користуючись рівнянням Ван-дер-Ваальса, знайти, в скільки разів треба збільшити температуру газу, щоб тиск збільшився удвічі.
Відповідь: 1,85.
5.480. 1 кмоль кисню знаходиться при температурі t=27°C і тиску р=107 Па. Знайти об'єм газу, вважаючи, що кисень за даних умов поводиться як реальний газ.
Відповідь: 0,231 м3.
5.481. 1 кмоль азоту знаходиться при температурі t = 27°C і тиску 5∙106 Па. Знайти об'єм газу, вважаючи, що азот за даних умов поводиться як реальний газ.
Відповідь: 0,49 м3.
5.482. Знайти ефективний діаметр молекули кисню, вважаючи, що критичні величини Тк і рк для кисню відомі.
Відповідь: 2,94∙10-10 м.
5.483. Знайти ефективний діаметр молекули азоту двома способами: 1) по даному значенню середньої довжини вільного пробігу молекул за нормальних умов 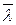 =9,5∙10-8 м, 2) по відомій величині постійної b в рівнянні Ван-дер-Ваальса.
=9,5∙10-8 м, 2) по відомій величині постійної b в рівнянні Ван-дер-Ваальса.
Відповідь: 1) 2,97∙10-10 м, 2) 3,13∙10-10 м.
5.484. Знайти середню довжину вільного пробігу молекул вуглекислого газу за нормальних умов. Ефективний діаметр молекули обчислити, вважаючи відомими для вуглекислого газу критичні температуру Тк і тиск рк.
Відповідь: 7,9∙10-8 м.
5.485. Знайти коефіцієнт дифузії гелію при температурі t=17°C і тиску p=1,5∙105 Па. Ефективний діаметр атома гелію обчислити, вважаючи відомими для гелію Тк і рк.
Відповідь: 3,5∙10-5 м2/с.
5.486. Побудувати ізотерми p=f(V) для одного кіломоля вуглекислого газу при температурі 0°С. Газ розглядати як: 1) ідеальний і 2) реальний. Значення V в м3/кмоль для реального газу узяти наступні: 0,07; 0,08; 0,10; 0,12; 0,14; 0,16; 0,18; 0,20; 0,25; 0,30; 0,35 і 0,40; для ідеального газу — в інтервалі 0,2≤V≤0,4 м3/кмоль.
5.487. Знайти тиск, обумовлений силами взаємодії молекул, укладених в одному кіломолі газу, що знаходиться за нормальних умов. Критична температура і критичний тиск цього газу рівні відповідно Tк = 417 К і рк= 77∙105 Па.
Відповідь: 1,31∙103 Па.
5.488. Для водню сили взаємодії між молекулами незначні; переважну роль грають власні розміри молекул. 1) Написати рівняння стану такого напівідеального газу. 2) Знайти, якої помилки ми припустимося при знаходженні числа кіломолей водню, що знаходиться в деякому об'ємі при температурі t = 0°С і тиску p = 2,8∙107 Па, не враховуючи власних розмірів молекул.
Відповідь: 2) 33 %.
5.489. В посудині об'ємом 0,01 м3 знаходиться 0,25 кг азоту при температурі 27° С. 1) Яку частину тиску газу складає тиск, обумовлений силами взаємодії молекул? 2) Яку частину об'єму судини складає власний об'єм молекул?
Відповідь: 1) 4,95 %, 2) 0,86 %.
5.490. 0,5 кмоля деякого газу займає об'єм V1= 1 м3. При розширенні газу до об'єму V2 = 1,2 м3 була виконана робота проти сил взаємодії молекул, рівна А=569 Дж. Знайти для цього газу постійну а, що входить в рівняння Ван-дер-Ваальса.
Відповідь: 1,36∙105 Н·м4/кмоль2.
5.491. 20 кг азоту адіабатично розширяються в пустоту від V1= l м3 до V2 = 2 м3. Знайти пониження температури при цьому розширенні, вважаючи відомою для азоту постійну а, що входить в рівняння Ван-дер-Ваальса. (Див. відповідь задачі 5.478.)
Відповідь: ΔТ = 2,33 К.
5.492. 0,5 кмоля трьохатомного газу адіабатично розширяється в пустоту від V1 = 0,5 м3 до V2 = 3 м3. Температура газу при цьому знижується на 12,2°. Знайти з цих даних постійну а, що входить в рівняння Ван-дер-Ваальса.
Відповідь: 3,64∙105 Н·м4/кмоль2.
5.493. 1) Який тиск треба прикласти, щоб вуглекислий газ перетворити на рідку вуглекислоту при температурі: а) 31°С і б) 50°С? 2) Який найбільший об'єм може займати 1 кг рідкої вуглекислоти? 3) Яка найбільша пружність насиченої пари рідкої вуглекислоти?
Відповідь: 1а) 73,95∙105 Па, 2) V = 2,9∙10-3 м3, 3) 73,95∙105 Па.
5.494. Знайти густину водяної пари при критичному стані, вважаючи відомою для них постійну b, що входить в рівняння Ван-дер-Ваальса. (Див. відповідь задачі 5.478.)
Відповідь: 196 кг/м3.
5.495. Знайти густину гелію в критичному стані, вважаючи відомими для гелію значення критичних величин Тк і рк.
Відповідь: 57 кг/м3.
5.496. 1 кмоль кисню займає об'єм 0,056 м3 при тиску 932∙105 Па. Знайти температуру газу, користуючись рівнянням Ван-дер-Ваальса в приведених величинах.
Відповідь: 400 К.
5.497. 1 кмоль гелію займає об'єм V = 0,237 м3 при температурі t=–200° С. Знайти тиск газу, користуючись рівнянням Ван-дер-Ваальса в приведених величинах.
Відповідь: 2,7∙106 Па.
5.498. Знайти, в скільки разів тиск газу більше його критичного тиску, якщо відомо, що його об'єм і температура удвічі більше критичних значень цих величин.
Відповідь: 2,45.
ЛІТЕРАТУРА
1. Детлаф А.А., Яворский Б.М. Курс физики. - М: Высшая школа, 1989.
2. Трофимова Т.И. Курс физики. - М.: Высшая школа, 1985.
3. Чолпан П.П. Основи фізики. - К.: Вища школа, 1995.
4. Дущенко В.П., Кучерук І.М. Загальна фізика. - К.: Вища школа, 1993.
5. Савельев И.В. Курс общей физики. - М: Наука, 1988. - Т.1.
6. Зисман Г.А., Тодес О.М. Курс общей физики. - М: Наука, 1974. - Т.1.
7. Стрелков С.П. Механика. - М: Наука, 1975.
8. Александров Н.В., Яшкин А.Я. Курс общей физики. Механика. - М.: Просвещение, 1978.
9. Кикоин А.К., Кикоин И.К. Молекулярная физика. - М.: Наука, 1976.
10. Телеснин Р.В. Молекулярная физика. — М.: Высшая школа, 1973.
11. Чертов А.Г., Воробьёв А.А. Задачник по физике. - М.: Высшая школа, 1981.
12. Волькенштейн ВС. Сборник задач по общему курсу физики. - М.: Наука, 1979.
13. Збірник задач з фізики / Барановський В.М., Бережний П.В., Водний П.О., Горбачук І.Т. та інш. - К.: Вища школа, 1993.
14. Гаркуша І.П., Курінний В.П., Певзнер М.Ш. Збірник задач з фізики. - К.: Вища школа, 1995.
15. Трофимова Т.И. Сборник задач по курсу физики. - М: Высшая школа,1991.
16. Гурьев Л.Г., Кортнев А.В. и др. Сборник задач по общему курсу физики. - М.: Высшая школа, 1972.
17. Фирганг Е.В. Руководство к решению задач по курсу общей физики. - М.: Высшая школа, 1978.
18. Коршак С.В., Гончаренко С.І., Коршак Н.М. Методика розв'язування задач з фізики. - К.: Вища школа, 1976.
ЗМІСТ
| ПЕРЕДМОВА 1 Основи молекулярно-кінетичної теорії речовини. 2 Явища переносу в газах. 3 Перший закон термодинаміки. Теплоємність газів. 4 Другий закон термодинаміки. 5 Реальні гази. ЛІТЕРАТУРА |
Навчальне видання
ПРАКТИКУМ З ФІЗИКИ
для студентів інженерних спеціальностей
Частина ІІ. Молекулярна фізика.
Укладачі: Ващенко В‘ячеслав Андрійович, д.т.н, професор,
Колінько Сергій Олександрович, к.ф-м.н., доцент,
Рудь Максим Петрович,
Нетребчук Лідія Кузьмівна
Бутенко Тетяна Іванівна, к.т.н., доцент
Бондаренко Максим Олексійович, к.т.н., доцент
Дата публикования: 2015-11-01; Прочитано: 769 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
