 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Обработка результатов. Исследование гомогенной каталитической реакции
|
|
Исследование гомогенной каталитической реакции
по дисциплине:
«Общая химическая технология»
Выполнил: студент гр. МХ-08-31
Проверил: Идрисова В. А.
ЛАБОРАТОРНАЯ РАБОТА
Цель работы:
Установить скорости гомогенной каталитической реакции разложения перекиси водорода от концентрации катализатора и температуры.
Н2О2 → Н2О + 1/2 О2
Порядок выполнения работы:
В реакционную колбу 1 (Рис.1) наливаем 100мл дистиллированной воды и 4 мл 3% раствора перекиси водорода.
Проверяем герметичность системы, затем открываем кран 4 и с помощью уравнительного сосуда 6 устанавливаем уровень воды в бюретке 5 на нулевой отметке. После этого заливаем в реакционную колбу 4 мл 10% раствора хлорида железа, быстро и плотно соединяем реактор 1 с бюреткой 5, закрываем кран 4, включаем мешалку, запускаем секундомер и начинаем замерять объем выделяющегося кислорода.
Замеры производим через 30 секунд, каждый раз предварительно уравнивая уровни воды в бюретке 5 и сосуде 6 путем стравливания кислорода через кран 4.
Проводим опыты при двух различных температурах (21оС и 31оС). Затем проводим аналогичную работу с 30% раствора хлорида железа в качестве катализатора.


Рисунок 1- Схема лабораторной установки.
1-колба на 250мл; 5- бюретка на 50 мл;
2- магнитик; 6- уравнительный сосуд;
3- магнитная мешалка; 7- соединительные трубки
4- кран;
Обработка результатов.
 Экспериментальные данные заносим в таблицу.
Экспериментальные данные заносим в таблицу.
Таблица 1- Результаты эксперимента №1
| Условия первого опыта: температура 21оС объем перекиси водорода: 4 мл объем 10% FeCl3: 4 мл | Условия второго опыта: температура 21оС объем перекиси водорода: 4 мл объем 30% FeCl3: 4 мл | ||
| Продол-жительность реакции от начала опыта | Объем выделившегося кислорода (Vτ),мл | Продол-жительность реакции от начала опыта | Объем выделившегося кислорода (Vτ),мл |
| 4 мин 35 с | 1,5 | 4 мин 10 с | 1,7 |
| 5 мин 05 с | 1,3 | 4 мин 40 c | 1,5 |
| 5 мин 35 с | 1,0 | 5 мин 10 с | 1,2 |
| 6 мин 05 с | 0,7 | 5 мин 40 c | 0,9 |
| 6 мин 35 с | 0,4 | 6 мин 10 с | 0,7 |
| 7 мин 05 с | 0,2 | 6 мин 40 c | 0,5 |
| 7 мин 35 с | 0,2 | 7 мин 10 с | 0,5 |
| 8 мин 05 с | 0,2 | 7 мин 40 c | 0,5 |
| ∑τ=3 мин 30 с | 
| ∑τ=3 мин 30 с | 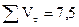
|
 Таблица 2- Результаты эксперимента №2
Таблица 2- Результаты эксперимента №2
| Условия первого опыта: температура 31оС объем перекиси водорода: 4 мл объем 10% FeCl3: 4 мл | Условия второго опыта: температура 31оС объем перекиси водорода: 4 мл объем 30% FeCl3: 4 мл | ||
| Продол-жительность реакции от начала опыта | Объем выделившегося кислорода (Vτ),мл | Продол-жительность реакции от начала опыта | Объем выделившегося кислорода (Vτ),мл |
| 2 мин 10 с | 1,5 | 1мин 45 с | 1,5 |
| 2 мин 30 с | 1,3 | 1 мин 55 с | 1,3 |
| 2 мин 50 с | 1,2 | 2 мин 05 с | 1,3 |
| 3 мин 10 с | 1,1 | 2 мин 15 с | 1,2 |
| 3 мин 30 с | 1,0 | 2 мин 25 с | 0,8 |
| 3 мин 50 с | 0,8 | 2 мин 35 с | 0,7 |
| 4 мин 10 с | 0,7 | 2 мин 45 с | 0,5 |
| 4 мин 30 с | 0,5 | 2 мин 55 с | 0,3 |
| 4 мин 50 с | 0,2 | 3 мин 05 с | 0,3 |
| 5 мин 10 с | 0,2 | 3 мин 15 с | 0,2 |
| 5 мин 30 с | 0,2 | 3 мин 25с | 0,2 |
| 5 мин 50 с | 0,2 | 3 мин 35 с | 0,2 |
| ∑τ=3 мин 40 с | 
| ∑τ=1 мин 50 с | 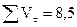
|
Для различных моментов времени от начала реакции (τ) вычисляем значения констант скоростей реакции, пользуясь кинетическим уравнением реакции 1-го порядка:
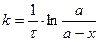 или
или 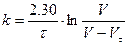
где:
а - начальное число молей исходного вещества;
(а – х) - число молей исходного вещества, оставшегося к моменту τ;
V - предельный объем выделившегося кислорода, т.е. пропорциональная исходному количеству перекиси водорода;
(V–Vτ) - объем кислорода, кислорода который выделяется при разложение перекиси водорода, оставшегося в системе к моменту времени τ, т.е. величина пропорциональная количеству перекиси водорода в данный момент времени.
Рассчитаем значения при t=21ОС для 10% FeCl3.

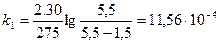 ;
;  ;
;
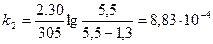 ;
; 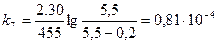 ;
;
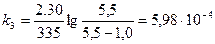 ;
;  ;
;
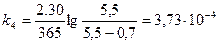 ;
;
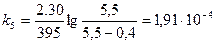
 .
.
Рассчитаем значения при t=21ОС для 30% FeCl3.

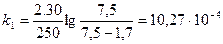 ;
; 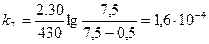 ;
;
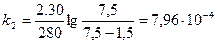 ;
; 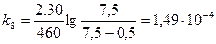 ;
;
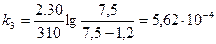 ;
;
 ;
;
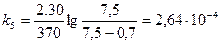 ;
;
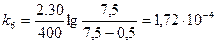 ;
;
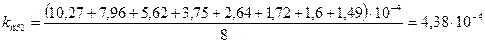
 Рассчитаем значения при t=31ОС для 10% FeCl3.
Рассчитаем значения при t=31ОС для 10% FeCl3.
 ;
;  ;
;
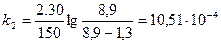 ;
;  ;
;
 ;
; 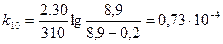 ;
;
 ;
; 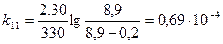 ;
;
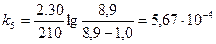 ;
;  ;
;
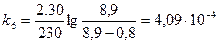 ;
;
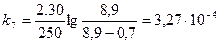

Рассчитаем значения при t=31ОС для 30% FeCl3.
 ;
; 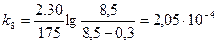 ;
;
 ;
;  ;
;
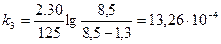 ;
;  ;
;
 ;
;  ;
;
 ;
;  ;
;
 ;
;
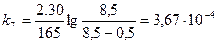

По средним значениям констант скоростей реакции k1 и k2 для двух различных температур (Т1 и Т2, оК) вычислим величину кажущейся энергии активации реакции:
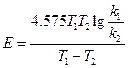
Рассчитаем энергию активации для 10% раствора FeCl3.
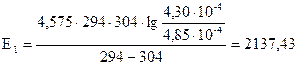 кал
кал
Рассчитаем энергию активации для 30% раствора FeCl3.
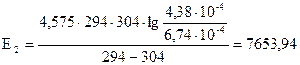 кал
кал
Определяем отношение констант скоростей реакций (k1/k2) отношение объемов раствора хлорного железа (V1/V2), использованных в соответствующих опытах при постоянной температуре. Две эти величины должны совпасть, т.е.

При t=21 ОС
 ;
;
При t=31 ОС


Вывод: научились устанавливать скорости гомогенной каталитической реакции разложения перекиси водорода от концентрации катализатора и температуры.
Н2О2 → Н2О + 1/2 О2
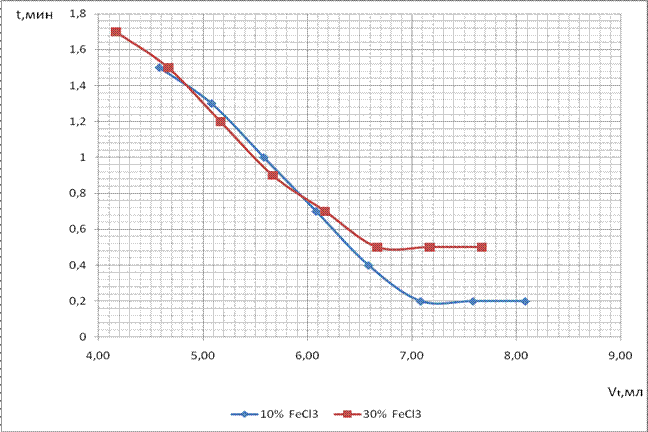

График зависимости количества выделенного кислорода от времени при 21 °С
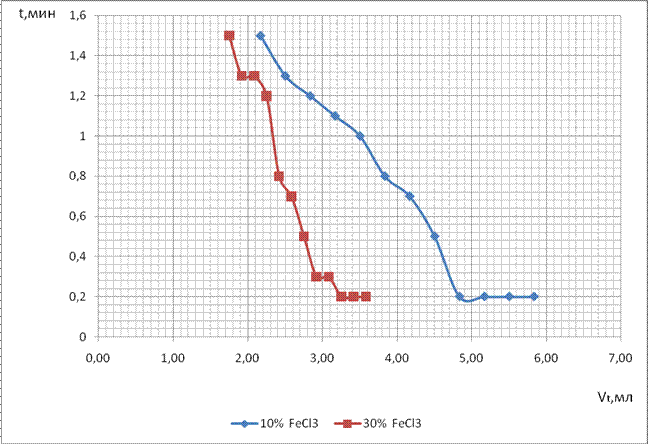
График зависимости количества выделенного кислорода от времени при 31 °С
Дата публикования: 2015-11-01; Прочитано: 879 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
