 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Следствия из закона Гесса
|
|
Из закона Гесса вытекают два следствия, которые позволяют определить тепловые эффекты химических реакций, не прибегая к измерениям.
Первое следствие из закона Гесса: тепловой эффект химической реакции при стандартных условиях равен сумме стандартных теплот образования продуктов реакции, умноженных на стехиометрические коэффициенты, минус стандартные теплоты образования исходных веществ, умноженные на соответствующие коэффициенты.
Теплотой образования ∆Нf, сложного вещества называется тепловой эффект реакции образования 1 моля данного вещества из простых. Теплоты образования простых веществ равны нулю.
Теплоты образования ∆Н°f,298 многочисленных соединений при стандартных условиях: давлении 1 атм и температуре 25°С (298 К), приводятся в термодинамических таблицах.
Теплоемкостью с называют количество теплоты, необходимое для нагревания 1 г (удельная теплоемкость) или 1 моля (молярная теплоемкость) вещества на 1 К.

Теплоемкость твердых, жидких и газообразных веществ увеличивается при повышении температуры.
Различают истинную теплоемкость, т. е. теплоемкость при данной температуре

и среднюю теплоемкость
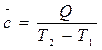
соответствующую конечному интервалу температур. Если этот интервал невелик, теплоемкость можно считать не зависящей от температуры.
В зависимости от условий нагревания теплоемкость может быть изобарной cp и изохорной cv:

Для выяснения зависимости теплового эффекта от температуры продифференцируем уравнение:

Учитывая выше написанное уравнение:
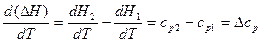
Это уравнение называется уравнением Кирхгофа. В этом уравнении величина ∆ср – это разность молярных теплоемкостей продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.
Для вычисления теплового эффекта реакции при заданной температуре T, необходимо проинтегрировать уравнение Кирхгофа:


Работа 1
Дата публикования: 2015-11-01; Прочитано: 336 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
