 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Дәріс 16 – Газ-сұйық- жүйесіндегі әртекті процесс
|
|
Мазмұны:
1. Г-С жүйесінің жылдамдығы
2. Г-С жүйесінде жүретін процестерді үдету тәсілдері
С - Г жүйесіндегі тепе-теңдік күйлер ережесімен, үлестіру заңымен және сұйық күйдегі химиялық реакциялардың тепе теңдігі тұрақтылығымен анықталады. С-Г екікүйлі жүйелерде тепе-теңдік «құрам қасиет» түріндегі күйлі диаграммалармен суреттеледі.
Г-С жүйесіндегі процестердің жылдамдығына абсорбция және десорбция мысалында қарастырылған ыңғайлы. Диффузиялық аймақта, процестің жалпы жылдамдығын және реактордың өлшемдерін диффузиялық саты анықтаған кезде, жалпы кинетикалық теңдеудің түрі: 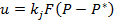 (1) немесе
(1) немесе  (2), бұл жерде Р және
(2), бұл жерде Р және  - сіңірілетін компоненттің нақтылы және сұйықтықпен тепе теңдік парциалды қысымы, С және
- сіңірілетін компоненттің нақтылы және сұйықтықпен тепе теңдік парциалды қысымы, С және 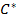 - ерітілген компоненттің сұйықтықтағы нақтылы және газбен тепе теңдік концентрациясы,
- ерітілген компоненттің сұйықтықтағы нақтылы және газбен тепе теңдік концентрациясы, 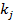 және
және 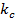 - газдың парциалды қысымы немесе сұйықтықтың концентрациясы бірлігінде көрсетілген массатасымалдау коэффициенттері.
- газдың парциалды қысымы немесе сұйықтықтың концентрациясы бірлігінде көрсетілген массатасымалдау коэффициенттері.
Абсорбция-десорбциялық процестерді моделдеу және есептеу кезінде критерилі теңдеулер қолданылады. Анықтаушы ретінде массатасымалдау коэффициентінің шамасы қолданылады, мысалы Nu=f(Re, Ga, Pr, Г), бұл жерде Ga=gl3/ν2 – Галилей критериі; Nuд= kl/D, — Нуссельт критериі; Re = wl/ν — Рейнольдс критерийі; Рrд = ν/D — Прандтлдің жылулық критериі; D – диффузиялық коэффициент, w — ағынның жылдамдығы; ν — тұтқырлықтың кинематикалық коэффициенті, l — сызықты сипаттамалы сызықтық өлшем, k – реакцияның жылдамдық тұрақтысы, Г – аппараттың геометриялық өлшемдері.
Турбулентті ережеде анықтаушы ретінде әрекеттесу критериі (Маргулис) қолданылады: Ma=k/ω, бұл жерде k – реакцияның жылдамдық тұрақтысы, ω – ағын жылдамдығы. Маргулис критериі процестің жылдамдығынның реакциялық ағынның жылдамдығына қатынасын сипаттайды. Әрекеттесу критериінің шамасымен газдардың сұйықтықтарда еру жылдамдығын шамалап бағалауға болады. Турбулентті ережедегі абсорбция кезінде жақсы еритін газдар үшін Ма>1, нашар еритін газдар үшін Ma<0,1, ал орташа еритін газдар үшін 0,1<Ma<1.
Массатасымалдау жылдамдығы және реактордың жұмысының нәтижелігі массатасымалдау коэффициентімен қатар ПӘК (пайдалы әрекеттесу коэффициенті) пен (η) сипатталады. k және η шамалары өзара байланысты. Сұйықтық пен газдың қиылысқан бағытындағы абсорбция үшін:  .
.
2. Реакция сұйықтық күйде жоғары жылдамдықпен жүретін жағдайды қарастырайық. Абсорбциялық процестердің ынғайлы кинетикалық моделі ретінде жұқа қабатты модел қолданылады. Бұл моделге сәйкес а) күйаралық беттің екі жағындада газбен сұйықтықтың ламинарлы шекаралық жұқа қабаттан кейін әрекеттесуші компоненттердің концентрациясы тұрақты болады және б) күйлердің бөліну бетінде сіңірілетін компоненттердің концентрацияларының арасында сұйықтық және газ күйінде Генри заңына бағынатын динамикалық тепе теңдік орнайды.
Аг + Bc → Dc модельді реакциясы Аг және Вс компоненттерінің реакциялық аймаққа диффузиясының және химиялық реакцияның нәтижесінде D өнімін түзіп жүреді. Егер химиялық реакция аймағы (реакция беті) сұйықтық ламинарлы жұқа қабаттың ішінде орналасса, онда концентрацияның үлестіру үлгісін 1 суретке сәйкес көрсетуге болады. Химиялық реакцияның жылдамдығы өте жоғары болғандықтан реакция аймағындағы әрекеттесуші компоненттердің концентрациясы 0-ге тең деп алынады (ССА=CCB=0).
Генри заңына сәйкес 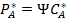 (3), мұнда
(3), мұнда  -Генри тұрақтысы, ол қысымның бірлігінде беріледі. Газ күйінде А компонентінің күйлердің бөліну бетіне диффузия жылдамдығы
-Генри тұрақтысы, ол қысымның бірлігінде беріледі. Газ күйінде А компонентінің күйлердің бөліну бетіне диффузия жылдамдығы 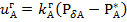 (4), бұл жерде
(4), бұл жерде  - газды жұқа қабат арқылы массатасымалдау коэффициенті. (3) теңдеуіне сәйкес
- газды жұқа қабат арқылы массатасымалдау коэффициенті. (3) теңдеуіне сәйкес 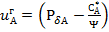 (5).
(5).
Сұйықтық күйдегі А реагентінің реакция бетіне диффузия жылдамдығы 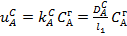 (6). Сұйықтықтағы В реагентінің реакция бетіне диффузия жылдамдығы:
(6). Сұйықтықтағы В реагентінің реакция бетіне диффузия жылдамдығы: 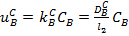 (7), бұл жерде
(7), бұл жерде  - сұйықтықтағы В компонентінің диффузия коэффициенті. Тұрақты ережеде
- сұйықтықтағы В компонентінің диффузия коэффициенті. Тұрақты ережеде  (5)-(7) теңдеулерінен
(5)-(7) теңдеулерінен 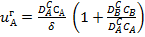 (8).
(8).
(8) кинетикалық теңдеудегі СВ-ң шамасы химиялық реакцияның хемосорбция жылдамдығына әсерін көрсетеді. Егер химиялық реакция мен диффузияның жылдамдығы бірдей болса, концентрацияның үлестіру сипаты 1 суретте көрсетілгендегіге қарағанда күрделі болады.
Егер хемосрбцияның қозғаушы күшін (4) теңдеуімен көрсетсек, онда сұйықтық күйдегі қайтымды химиялық реакция үшін  (9), бұл жерде К – сұйықтық күйдегі химиялық реакцияның тепе теңдік тұрақтысы, х – абсорбенттің (сіңіргіштің) сіңірілетін компонентпен қанығу дәрежесі.
(9), бұл жерде К – сұйықтық күйдегі химиялық реакцияның тепе теңдік тұрақтысы, х – абсорбенттің (сіңіргіштің) сіңірілетін компонентпен қанығу дәрежесі.
Хемосорбцияның жылдамдығының физикалық абсорбциямен салыстырғандағы жоғарылауын сұйықтық күйдегі массатасымалдау коэффициентінің теңдеуі бойынша анықтауға болады. Егер шартты түрде хемосорбцияның қозғаушы күші физикалық абсорбцияның қозғаушы күшіне эквивалентті деп қабылдасақ, онда 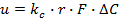 (10), бұл жерде r – реакцияның нәтижесінде сұйықтық күйдегі абсорбцияның үдеу коэффициенті, kc – сұйықтық күйдің концентрация бірлігінде көрсетілген абсорбция коэффициенті.
(10), бұл жерде r – реакцияның нәтижесінде сұйықтық күйдегі абсорбцияның үдеу коэффициенті, kc – сұйықтық күйдің концентрация бірлігінде көрсетілген абсорбция коэффициенті.
Жалпы түрде r=(k1, k2, τ0, P, C, D1, D2, …) (11), бұл жерде k1, k2 тура және кері реакциялардың жылдамдық тұрақтылары, τ0 жаңару мерзімі (газдың сұйықтықпен (оның бетінің бір жаңарудан екінші жаңаруға дейінгі) әрекеттесу уақыты).
Өзін-өзі бақылауға арналған сұрақтар:
1. Г-С жүйесіндегі әртекті процестер және оның жылдамдығы
2. Абсорбция процесінің үдеу коэффициенттеріне әсер ететін факторлар
3. Г-С жүйесіндегі жүретін процестерді үдетуі тәсілдері
Ұсынылған әдебиеттер:
1. Общая химическая технология: в 2-х ч.,/под ред. И.П. Мухленова. М:1984.
2. Кутепов А.М. и др. Общая химическая технология. М:1990.
3. Основы химической технологии/под ред. И.П. Мухленова М:1991.
4. Вольфкович С.И. Общая химическая технология. М: 1959
5. Соколов Р.С. Химическая технология: в 2-х т. М: 2000.
Дата публикования: 2015-10-09; Прочитано: 1698 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
