 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Дәріс 14 – Біртекті химиялық процестер
|
|
Мазмұны:
1. Біртекті химиялық процестердің жылдамдығы.
2. Біртекті реакцияның жылдамдығына концентрация, температура, қысымның әсері
1. Біртекті процестер біртекті ортада, яғни бөліну беті болмайтын сұйық немесе газды қоспаларда жүреді. Біртекті ортада көптеген процестер тізбекті механизм бойынша жүреді: тотығу, көмірсутектердің полимеризациясы және пиролизі, көмірсутектерді галогендеу, хлорсутекті элементтерден синтездеу және т.б. Реакцияның көбі бірнеше сатыда жүреді. Реакцияның жалпы жылдамдығы әдетте ең жәй жүретін сатының жылдамдығымен анықталады.
Реакцияның реті дегеніміз кинетикалық теңдеудегі әрекеттесуші заттардың концентрациясының дәреже көрсеткіштерінің жиынтығы. Реакциялар реті бойынша нольдік, бірінші, екінші, үшінші және үлесті болып бөлінеді.
Реакцияның молекулалығы дегеніміз реакциясының жалпы теңдеуінің стехиометриясы бойынша әрекеттесетін молекулалардың жалпы саңы. Молекулалығы бойынша реакция бір, екі және үшмолекулалы болып бөлінеді.
Бірмолекулалы реакцияға ішкімолекулалық қайта топтану реакциялары А → D (изомеризация, инверсия) және ыдырау реакциялары A → D + R жатады.
Екімолекулалы реакциялар қосып алу А + А → А • А немесе А + В → АВ, ыдырату 2А → D + R және орын басу (алмасу) А + ВС → АВ + С немесе АВ + CD → АС + BD реакцияларына бөлінеді.
Үшмолекулалы реакциялар өте сирек кездеседі, әдетте олар бірнеше саты бойынша жүреді. Үшмолекулалы реакцияларға қосып алу, алмасу, қайта құрылу реакциялары жатады, яғни
ЗА → D; 2А + В → D + R и A + B+C→D+R+…
2. Әрекеттесуші заттардың концентрациясының әсері
Жалпы түрде химиялық реакцияның жылдамдығына концентрацияның әсері мына теңдеумен сипатталады:
u = k∆C (1),
жылдамдық u өнімнің салмағының G реакциялық көлем бірлігіндегі концентрациясының немесе айналдыру дәрежесінің х уақыт аралығында өзгеруі бойынша көрсетілуі мүмкін: 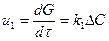 (2),
(2), 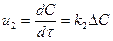 (3) немесе
(3) немесе  (4), мұнда ∆ С реакцияның ретіне, оның қайтымдылығына және араластыру дәрежесіне байланысты әртүрлі жолымен анықталады.
(4), мұнда ∆ С реакцияның ретіне, оның қайтымдылығына және араластыру дәрежесіне байланысты әртүрлі жолымен анықталады.
Жалпы түрде қарапайым қайтымсыз реакцияның кинетикалық теңдеуі әрекеттесуші салмақтар заңы бойынша мынадай түрде көрсетіледі (аА+ bB →өнімдер):
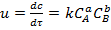 (5)
(5)
Егер реагенттердің концентрациясын уақыт аралығындағы айналдыру дәрежесі арқылы көрсетсек, онда бірінші ретті қайтымсыз реакцияның жылдамдығы мына теңдеумен анықталады:
 (6).
(6).
Бірінші ретті қайтымды реакцияның кинетикалық теңдеуі күрделі болады, себебі ол тура және кері реакциялардың жылдамдығын ескереді. Мысалы, тиоционат және тиомочевина айналымдарын NH4SCN ↔ (NH2)2SC жалпы түрде былай көрсетуге болады  . Бұл реакция бір мезгілде тура және кері реакциялардың жылдамдықтарының айырмасына тең болады. Ал бұл реакциялардың әрқайсысы бір молекулалы болып табылады. Идеалды ығыстыру реакторы үшін жылдамдық теңдеуінің түрі:
. Бұл реакция бір мезгілде тура және кері реакциялардың жылдамдықтарының айырмасына тең болады. Ал бұл реакциялардың әрқайсысы бір молекулалы болып табылады. Идеалды ығыстыру реакторы үшін жылдамдық теңдеуінің түрі:  (7). Тепе теңдік мезетінде dx/dτ=0, яғни тура және кері реакциялардың жылдамдығы тең болады. Сондықтан
(7). Тепе теңдік мезетінде dx/dτ=0, яғни тура және кері реакциялардың жылдамдығы тең болады. Сондықтан 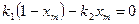 (8). Бұл теңдеуден жылдамдық тұрақтысы
(8). Бұл теңдеуден жылдамдық тұрақтысы  (9). Бұл теңдеуді қолданып К белгілі болған жағдайда тура және кері реакциялардың жылдамдық тұрақтыларын есептейді.
(9). Бұл теңдеуді қолданып К белгілі болған жағдайда тура және кері реакциялардың жылдамдық тұрақтыларын есептейді.
Екінші ретті қайтымсыз реакцияның А + В → С + D жылдамдығыда әрекеттесуші заттар А және Вң концентрациясына пропорционал. Ығыстыру реакторы үшін:  (10).
(10).
Үшінші ретті реакцияның жылдамдығы үш әрекеттесуші заттардың А, В, D концентрациясына пропорционал. Реагенттер эквивалентті қатынаста алынған деп санасақ 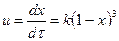 (11). Үшінші ретті реакциялардың жылдамдығы төмен болғандықтан тәжірибелік жағдайда өте сирек қолданады.
(11). Үшінші ретті реакциялардың жылдамдығы төмен болғандықтан тәжірибелік жағдайда өте сирек қолданады.
Қысымның жоғарлауы реагенттердің концентрациясының жоғарлауы сияқты газды реакцияларды жылдамдатады, себебі, қысымның жоғарлауымен компоненттердің ретінің өсуімен жоғарылайды.
Аррениус теңдеуіне сәкес температураның жоғарлауы біртекті реакцияларды жылдамдатады. Сонымен, барлық негізгі параметрлердің әсерін ескертетін процестің жылдамдығының теңдеуі: 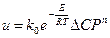 (12). Бұл теңдеуді процестің кинетикалық моделі деп атайды.
(12). Бұл теңдеуді процестің кинетикалық моделі деп атайды.
Температура жоғарылаған кезде дифузиялық процестерде үдейеді. Бірақ температураны жоғарлату тепе теңдік шарттарымен, жаңама реакциялардың пайда болуымен және басқада себептермен шектеледі. Барлық процестер үшін тиімді температура тағайындауға тырысады, бұл кезде қыздыруға кеткен шығындар процестің үдеуімен аяқталуы қажет.
Араластырусұйықтықтардағы диффузия жылдамдығы газдардағыға қарағанда ондаған және жүздеген мың есе аз. Ерітінділерді араластыру диффузиялық кедергінің төмендеуінің әсерінен процестің жалпы жылдамдығын өте көп жоғарылатады.
Өзін-өзі бақылауға арналған сұрақтар:
1. Біртекті процестер туралы жалпы түсінік. Мысалдар келтіріңіз
2. Реакцияның реті және молекулалығы
3. Біртекті процестердің жылдамдығы
Ұсынылған әдебиеттер:
1. Общая химическая технология: в 2-х ч.,/под ред. И.П. Мухленова. М:1984.
2. Кутепов А.М. и др. Общая химическая технология. М:1990.
3. Основы химической технологии/под ред. И.П. Мухленова М:1991.
4. Вольфкович С.И. Общая химическая технология. М: 1959
5. Соколов Р.С. Химическая технология: в 2-х т. М: 2000.
Дата публикования: 2015-10-09; Прочитано: 2677 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
