 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Дәріс 15 – Әртекті химиялық процестер
|
|
Мазмұны:
1. Әртекті процестердің жалпы ерекшеліктері
2. «газ - қатты» жүйесіндегі әртекті процесс
1. Әртекті процестер екі немесе оданда көп әрекеттесуші күйлердің болуымен сипатталады, сондықтан олар заттардың күйлердің бөліну беті арқылы тасымалдануымен жүреді. Бұл жағдайда күйаралық салмақтасымалдау жеке процесс болуы мүмкін немесе әрекеттесуші компоненттердің химиялық айналдыруымен бірге жүруі мүмкін.
Әртекті процестердің тепе тендігі мен жылдамдығы көптеген айнымалылардың функциясы болып табылады, сондықтан әртекті процестерді сандық түрде сипаттау өте күрделі. Қарапайымдылық үшін процестерді сатыға бөліп қарастырады. Алдымен ең жәй жүретін сатыны (диффузия немесе химиялық реакция) анықтап, оны математикалық сипаттайды. Содан кейін бүтін процесті сипаттайды. Мұндай әдіс диффузия мен химиялық реакцияның жылдамдықтары әртүрлі болғанда қолданылады. Ал басқа жағдайда осы екі факторды ескеру қажет, сондықтан кинетикалық теңдеу өте күрделеніледі.
Әртекті химиялық процестердегі тепе тендік біртекті процестердегідей дайын өнімнің шығымын анықталады. Әртекті процестердің тепе тендігіне температура, қысым, әрекеттесуші заттардың концентрация және т.б. әсер етеді. Күйлердің тепе тендігі күйлер ережесімен анықталады.
2. Г-Қ жүйесіндегі процестердің жылдамдағын зерттеу әрекеттеспеген дәні бар сфералық бөлшектің моделінің негізінде қарастырылады. Бұл модельге сәйкес химиялық реакция қатты бөлшектің бетінде жүреді, содан кейін бөлшектін ішіне еңеді. Нәтижесінде оның бетінде реакция өнімдерінің қатты, кеуекті қабаты («күл») пайда болады. Процестің негізгі сатылары:
1. Газды реагенттің газ ағынынан қатты бетке диффузиясы;
2. Газды реагенттің «күл» қабаты арқылы ішкі диффузиясы;
3. Қатты реагенттің бетіндегі химиялық реакция;
4. Газды реакция өнімдерінің «күл» қабаты арқылы диффузиясы.
5. Газды өнімдердің газ ағынының дәніне сыртқы диффузиясы.
Бұл модельдің жалпы кинетикалық теңдеуінің түрі: 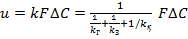 (1), бұл жерде u – τ уақыттағы (реакцияның бөлшектің ортасына жылжуына қажет уақыт) процестің орташа жылдамдығы, kг – массатасымалдау коэффициенті (1/kг – газды шекаралық жұқа қабықшаның кедергісі); kқ — қатты беттің бірлігіне қатысты химиялық реакцияның жылдамдық тұрақтысы; 1/kз = rб /2D — реакцияның қатты өнімдерінің қабатының (орташа қалындығы ∆rб/2 болғанда) кедергісі; rб— бөлшектердің радиусы; D — газдың ішкі диффузия коэффициенті (бөлшектің кеуектеріндегі); ∆С — процестің қозғаушы күші (газ күйдегі газды реагенттің концентрациясына эквивалентті, яғни ∆C = Сг).
(1), бұл жерде u – τ уақыттағы (реакцияның бөлшектің ортасына жылжуына қажет уақыт) процестің орташа жылдамдығы, kг – массатасымалдау коэффициенті (1/kг – газды шекаралық жұқа қабықшаның кедергісі); kқ — қатты беттің бірлігіне қатысты химиялық реакцияның жылдамдық тұрақтысы; 1/kз = rб /2D — реакцияның қатты өнімдерінің қабатының (орташа қалындығы ∆rб/2 болғанда) кедергісі; rб— бөлшектердің радиусы; D — газдың ішкі диффузия коэффициенті (бөлшектің кеуектеріндегі); ∆С — процестің қозғаушы күші (газ күйдегі газды реагенттің концентрациясына эквивалентті, яғни ∆C = Сг).
Газды шекаралық жұқа қабат арқылы сыртқы диффузия сатысы жүретін болса, процестің жылдамдығы мына теңдеумен өрнектеледі:  (2), бұл жерде GA және GB – реагенттердің мөлшері, моль немесе кг; b – қатты заттың 1 молімен немесе 1 кг әрекеттесетін газдың моль саны; Fб – қатты бөлшектің бастапқы беті (
(2), бұл жерде GA және GB – реагенттердің мөлшері, моль немесе кг; b – қатты заттың 1 молімен немесе 1 кг әрекеттесетін газдың моль саны; Fб – қатты бөлшектің бастапқы беті (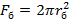 , себебі оның пішімі сфералы).
, себебі оның пішімі сфералы).
Газды реагенттің реакция өнімдерінің қабаты арқылы ішкі диффузиясы жәй жүргенде, процестің жылдамдығы Фика заңына сәйкес мына теңдеумен өрнектеледі: 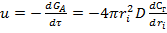 (3), бұл жерде ri – τ уақытындағы әрекеттеспеген дәннің радиусы, D – заттының диффузия коэффициенті.
(3), бұл жерде ri – τ уақытындағы әрекеттеспеген дәннің радиусы, D – заттының диффузия коэффициенті.
Химиялық реакция сатысы жәй жүргенде, процестің жылдамдығы мына теңдеумен өрнектеледі: 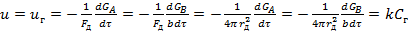 (4), бұл жерде
(4), бұл жерде 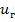 - химиялық реакцияның жылдамдығы; k – химиялық реакцияның жылдамдық тұрақтысы.
- химиялық реакцияның жылдамдығы; k – химиялық реакцияның жылдамдық тұрақтысы.
Өзін-өзі бақылауға арналған сұрақтар:
1. Әртекті процестер және олардың түрлері
2. Әртекті процестердің жалпы жылдамдығы
3. Г-Қ жүйесіндегі әртекті процестің жылдамдығы
Ұсынылған әдебиеттер:
1. Общая химическая технология: в 2-х ч.,/под ред. И.П. Мухленова. М:1984.
2. Кутепов А.М. и др. Общая химическая технология. М:1990.
3. Основы химической технологии/под ред. И.П. Мухленова М:1991.
4. Вольфкович С.И. Общая химическая технология. М: 1959
5. Соколов Р.С. Химическая технология: в 2-х т. М: 2000.
Дата публикования: 2015-10-09; Прочитано: 1427 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
