 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Электролиз хлоридов натрия в ваннах с фильтрующей диафрагмой
|
|
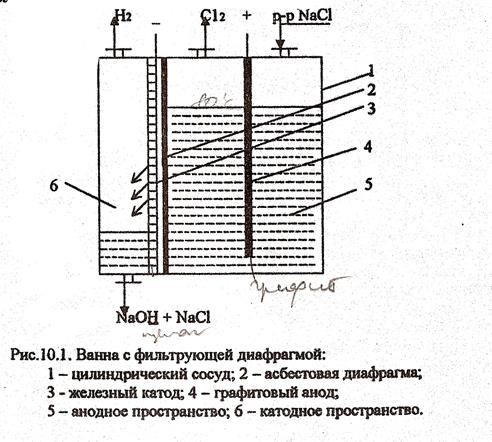 |
Ванна с фильтрующей диафрагмой представляет собой цилиндрический сосуд (1) внутри которого находится асбестовая диафрагма (2) железный катод (3) в виде сетки и графитовый анод (4)
.
При пропускании постоянного электрического тока на аноде происходит разряд ионов хлора и образуются молекулы газообразного хлора:
2Cl --2e = Cl2
.на катоде разряжаются ионы водорода:
2H ++ 2e = H2.
Ионы гидроксила и натрия образуют едкий натрий:
Na + + OH - = NaOH.
Подготовленный раствор NaCl подается в анодное пространство (5) ванны, где при прохождении электрического тока происходит выделение CL2 на аноде. Раствор хлорида натрия фильтруется через диафрагму (2), водород в катодном пространстве (6) выделяется на катоде и выводится из катодного пространства. Образовавшийся NaOH вместе с неразложившейся поваренной солью стекает на дно катодного пространства и выводится из нижней части ванны.
На переносе тока от катода к аноду наряду с ионами Cl- принимает участие и OH- ион. Материал анода (графит) взаимодействует с кислородом в момент его выделения по реакции:
C + O2 = CO2.
Чтобы уменьшить участие OH- ионов в переносе тока и связанные с этим нежелательные процессы устанавливают обратный поток электролита из анодного в катодное пространство через диафрагмы. Диафрагма предотвращает контакт выделяющего хлора с водородом или с одновременно образующейся щёлочью.
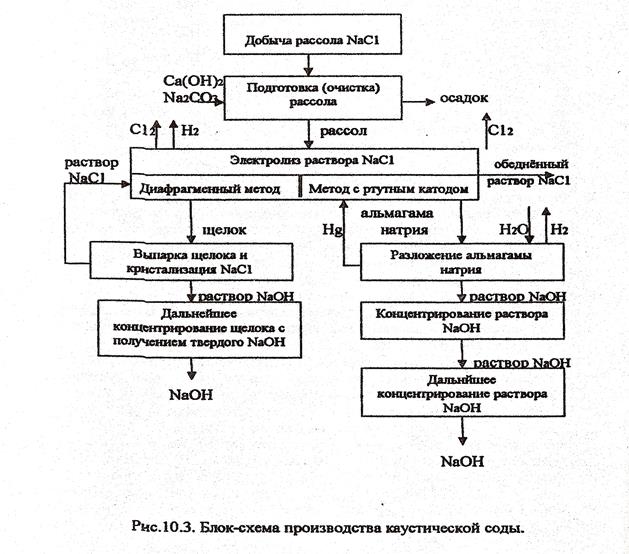
Блок-схема:
Вопрос № 31
Производство едкого натра и хлора электрохимическим способом. Электролиз хлоридов натрия в ваннах с ртутным катодом. Блок-схема промышленного производства едкого натра и хлора. Основные показатели процесса электролиза.
Едкий натр (каустическая сода) широко используется в ряде отраслей промышленности: производство мыла и СМС, алюминия, для очистки нефтепродуктов и газов, производстве бумаге, искусственных волокон и в других отраслях.
Хлор широко используется при получение органических хлорпроизводных, изготоволение пластических масс (поливинилхлоридных), синтетических каучуков., растворителей, соляной кислоты. Несмотря на значительную экологическую опасность хлора и его производных, промышленное производство хлора в мире остаётся очень высоким.
К электрохимическим производствам относят химические процессы, протекающие в водных процессах или расплавах под действием постоянного электрического тока. (при помощи процесса электролиза).
Путем электролиза возможно получение химических продуктов высоко чистоты. К недостаткам электролитических процессов следует отнести высоких расход энергии при электролизе, что увеличивает себестоимость получаемого продукта.
При электролизе помимо основного процесса, протекает ряд побочных, также связанная с затратами энергии. Мерой эффективности использования энергии при электролизе служит коэффициент использования энергии (μ), который равен отношению количества энергии, теоретически необходимой для выделения единицы продукта (Wт), к действительно затраченной (Wпр):
μ= (Wт/ Wпр)*100%; μ=(Vr/Vпр)*η
где: Vт- теоретическое напряжение на электролизе, В;
Vпр- практическое напряжение в ванне В.
На практике всегда стремятся иметь максимальный коэффициент использования энергии. Для этого создают условия, при которых напряжение в ванне невелико, выход по току большой.
 |
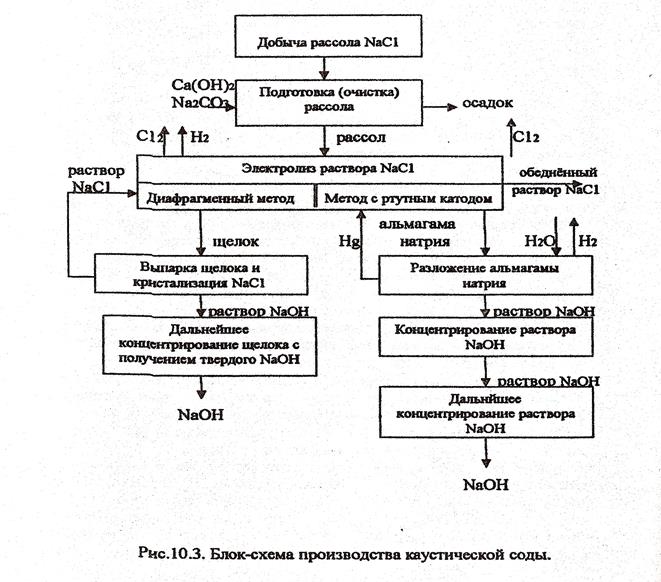
Электролиз хлоридов натрия в ваннах с ртутным катодом.
Ванна с ртутным катодом состоит и 2 частей – электролизёра и разлагателя, соединенных друг с другом. Электролизёр (1) представляет собой длинный закрытый ящик. В него опущены графитовые аноды (2), катодом служит ртуть (3), которая течёт по слегка наклонённому дну ванны. Раствор NaCl концентрацией 310-315 г/л непрерывно подается в электролизер. При прохождении постоянного тока на анодах выделяется хлор по реакции:
2Cl --2e = Cl2
На ртутном катоде перенапряжение выделения водорода очень велико и H+ ионы не разлагаются, а происходит разряд ионов натрия. В результате образуется натрий:
Na+ + e = Na.
который реагирует со ртутью, образуя амальгаму натрия:
Na + nHg = NaHgn.
Температура электролита 70-80оС. Из верхней части электролизера непрерывно выводится обедненный раствор NaCl, а снизу – амальгама натрия, которая поступает в разлагатель (4), где она обрабатывается водой. При этом происходит образование NaOH, водорода и ртути:
NaHgn + H2O = NaOH + 0,5H2 + nHg.
Амальгама натрия разлагается на специальных насадках. Выделившуюся ртуть с помощью насоса (5) возвращают в электролизер. Т.о. ртуть находится в замкнутом цикле. Обедненный раствор хлорида натрия донасыщают хлоридом натрия и вновь возвращают на электролиз. Из разлагателя выводится раствор очень чистой щелочи.
Преимущества ванны с ртутным катодом – высокая концентрация полученной щёлочи. Недостаток – повышенный расход энергии.
Блок-схема:
Вопрос № 32
Производство фосфорной кислоты термическим и экстракционным способами. Химизм процессов. Экологические проблемы процессов производства фосфорной кислоты. Блок-схема экстракционного процесса.
Фосфорная кислота используется для получения ряда удобрений, также является важным продуктом для получения технических реактивов, применяется при синтезе ряда органических продуктов, в производстве активированного угля, для создания на металлах защитных покрытий. Её соли – ортофасфаты –используются в производстве фосфорных удобрений, эмалей, огнестойких материалов.
Фосфорная кислота производится двумя способами: термическим из элементарного азота и экстракционным (разложение природных фосфатов)
Термический способ получения фосфорной кислоты включает сжигание элементарного фосфора в кислороде воздуха, охлаждение газов, гидратацию P2O5 и абсорбцию H3PO4, улавливание туманообразной кислоты.
При сжигании паров фосфора, выходящих из печи, или расплавленного фосфора получается фосфорный ангидрид:
2P2 + 5O2 = 2P2O5.
Далее фосфорный ангидрид взаимодействует с водой. Сначала образуется метафосфорная кислота:
P2O5 + H2O = 2HPO3,
которая при охлаждении и наличии избытка воды гидратируется с получением термической фосфорной кислоты, отличающейся высокой чистотой и концентрацией:
HPO3 + H2O = H3PO4.
Возможно получение кислоты любой концентрации. Высокая степень чистоты достигается при использовании любых фосфатов, в том числе и низкокачественных без их предварительного обогащения. Недостаток – дороговизна процесса получения фосфора.
Дата публикования: 2015-10-09; Прочитано: 2728 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
