 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Физико-химические закономерности в химической технологии
|
|
68. Задание {{ 246 }} ТЗ № 132
Используя принцип Ле Шателье, возможны смещения вправо равновесия реакции 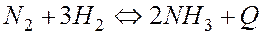 ,при условии:
,при условии:
1 повышения давления в реакционной смеси
2 пониженния концентрации исходного синтез-газа
3 повышения температуры в реакционной смеси
4 понижения давления в реакционной смеси
69. Задание {{ 247 }} ТЗ № 133
Условия смещения равновесия вправо для реакции 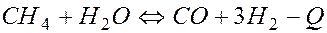
1 повышение давления в реакционной смеси
2 понижения температуры в реакционной смеси
3 повышения температуры в реакционной смеси
4 понижение концентрации исходного синтез - газа
70. Задание {{ 248 }} ТЗ № 134
Условия смещения равновесия влево для реакции
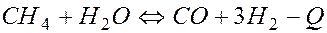
1повышение давления в реакционной смеси
2 понижение температуры реакции
3 вывод продуктов реакции из реакционной зоны 4£ повышение температуры в реакционной смеси
71. Задание {{ 249 }} ТЗ № 135
Условия смещения равновесия влево для реакции 
1 повышение давления в реакционной смеси
2 повышение температуры в реакционной смеси
3 изменение давления не влияет на смещение равновесия
4 понижение температуры в реакционной зоне
72. Задание {{ 250 }} ТЗ № 136
Используя принцип Ле Шателье, возможны ли смещения вправо равновесия реакции, если: 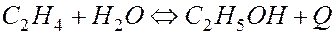
1 повысить давление в реакционной смеси
2 повысить температуру в реакц. смеси
3 выводить продукты реакции из реакц. зоны
4 понизить давление в реакционной смеси
73. Задание {{ 252 }} ТЗ № 1
Используя принцип Ле Шателье, возможны смещения вправо равновесия реакции  , при условии:
, при условии:
1 повышение давления в реакционной смеси
2 понижение концентрации исходного синтез-газа
3 повышение температуры в реакционной смеси
4 понижение давления в реакционной смеси
74. Задание {{ 674 }} ТЗ № 1
Увеличению равновесного выхода продукта способствует повышение:
1 давления в газовых реакциях, протекающих с увеличением объемов
2 температуры для экзотермических реакций
3 концентрации исходных реагентов
4 давление в жидкофазовых процессах
75. Задание {{ 675 }} ТЗ № 2
Принцип Ле - Шателье применим для процессов:
1 гомогенных
2 обратимых
3 гетерогенных
4 экзотермических
76. Задание {{ 676 }} ТЗ № 3
Увеличить выход продукта для случая обратимого экзотермического процесса можно:
1 уменьшив температуру процесса
2 снизив концентрацию исходных реагентов
3 увеличив температуру процесса
4 увеличив давление
77. Задание {{ 677 }} ТЗ № 4
Увеличить выход продукта для случая обратимого эндотермического процесса можно:
1 уменьшив температуру процесса
2 увеличив концентрацию исходных веществ
3 понизить концентрацию исходных веществ
4 увеличив температуру процесса
78. Задание {{ 678 }} ТЗ № 5
Уменьшение давления в обратимом газофазном процессе:
1 смещает равновесие в сторону продуктов реакции
2 смещает равновесие в сторону исходных веществ
3 смещает равновесие в соответствии с изменением объема реакционной массы в ходе процесса
4 не влияет на равновесие
79. Задание {{ 679 }} ТЗ № 6
Увеличение коцентрации исходных реагентов в обратимом процессе:
1 увеличивает выход продукта
2 уменьшает выход продукта
3 изменяет выход продукта в соответствии с температурным эффектом реакции
4 не влияет на выход продукта
80. Задание {{ 680 }} ТЗ № 7
Увеличение давления в обратимом газофазном процессе:
1 всегда смещает равновесие в сторону увеличения выхода продуктов реакции
2 всегда смещает равновесие в сторону исходных веществ
3 смещение равновесия зависит от изменения объема реакционной массы в ходе процесса
4 не влияет на равновесие
81. Задание {{ 681 }} ТЗ № 8
Повышение температуры в обратимых эндотермических процессах:
1 смещает равновесие в сторону продуктов реакции
2 смещает равновесие в сторону исходных веществ
3 не влияет на равновесие
4 смещение равновесия зависит от от типа используемого реактора
82. Задание {{ 682 }} ТЗ № 9
Факторы, влияющие на равновесие в гомогенных жидкофазных экзотермических процессах:
1 температура и давление
2 давление и концентрация исходных реагентов
3 температура и концентрация исходных реагентов
4 только давление
83. Задание {{ 683 }} ТЗ № 10
Факторы, влияющие на равновесие в гомогенных жидкофазных эндотермических процессах:
1 давление и концентрация исходных реагентов
2 температура и концентрация исходных реагентов
3 давление и температура
4 только давление
84. Задание {{ 684 }} ТЗ № 11
Повышение температуры в гомогенных газофазных обратимых процессах смещает равновесие:
1 в сторону конечных продуктов
2 в сторону исходных веществ
3 в соответствии с тепловым эффектом реакции
4 не влияет на равновесие
85. Задание {{ 685 }} ТЗ № 12
Увеличение давления в обратимом газофазном процессе смещает равновесие:
1 всегда в сторону увеличения выхода продуктов реации
2 зависит от изменения объема реакционной массы в ходе процесса
3 не влияет на равновесие
4 всегда в сторону исходных веществ
86. Задание {{ 686 }} ТЗ № 13
Увеличение давления в обратимом жидкофазном процессе:
1 смещает равновесие в сторону конечных продуктов
2 смещает равновесие в сторону исходных веществ
3 не влияет на равновесие
4 смещает равновесие в соответствии с тепловым эффектом реакции
87. Задание {{ 687 }} ТЗ № 14
В обратимых процессах 100%-ная степень превращения сырья достигает:
1 если процесс гетерогенный
2 если процесс эндотермический
3 никогда не достигается
4 если процесс гомогенный
88. Задание {{ 688 }} ТЗ № 15
Для реакции 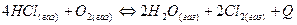 повышение температуры:
повышение температуры:
1 увеличит равновесную концентрацию Cl2
2 уменьшит равновесную концентрацию Cl2
3 не влияет на равновесную концентрацию Cl2
4 изменит равновесную концентрацию Cl2 в соответствии с типом используемого реактора
90. Задание {{ 690 }} ТЗ № 17
Для реакции 
 равновесие можно сместить в сторону конечных продуктов, если:
равновесие можно сместить в сторону конечных продуктов, если:
1 увеличить давление в реакторе
2 увеличить температуру в реакторе
3 выводить продукты реакции из реакционной зоны
4 хлор подавать в избыточном количестве
102. Задание {{ 703 }} ТЗ № 30
Повышение температуры смещает равновесие право в реакциях:
1 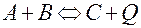
2 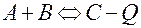
3 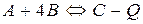
4 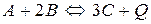
103. Задание {{ 704 }} ТЗ № 31
Повышение давления сдвигает равновесия вправо:
1 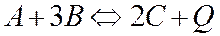
2 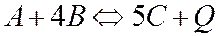
3 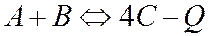
4 
104. Задание {{ 705 }} ТЗ № 32
Равновесный выход продукта- это количественная характеристика:
1 меньше 1
2 больше 1
3 равно 1
4 больше 10
105. Задание {{ 706 }} ТЗ № 33
Равновесие гетерогенных процессов определяется:
1 константой равновесия
2 катализатором
3 концентрацией
4 правилом фаз
106. Задание {{ 739 }} ТЗ № 144
Скорость химической реакции это:
1 отношение количества исходного вещества к продукту
2 изменение концентрации исходного вещества в единицу времени
3 количество побочных продуктов в единицу времени
4 изменение концентрации продукта в еденицу времени
107. Задание {{ 740 }} ТЗ № 145
Константа скорости процесса-сложная величина, зависящая от:
1 химических свойств реагирующих веществ
2 конструкции аппарата
3 концентрации реагентов
4 температуры
108. Задание {{ 741 }} ТЗ № 146
Повышение константы скорости в гетерогенных процессах может быть достигнуто:
1 перемешиванием
2 давлением
3 повышением коцентрации исходных реагентов
4 повышением температуры
109. Задание {{ 742 }} ТЗ № 147
Влияние температуры реагирующих масс на константу скорости реакции определяется:
1 уравнением Аррениуса
2 законом Менделеева
3 правилом Вант-Гоффа
4 законом действующих масс
110. Задание {{ 743 }} ТЗ № 148
Согласно правила Ванг-Гоффа-температурный коэффициент скорости реакции находятся в пределах:
1 1-2
2 2-4
3 5-6
4 6-8
111. Задание {{ 744 }} ТЗ № 149
Температуры, при которых применимо правило Вант-Гоффа:
1 500-700
2 10-400
3 700-1000
4 1000-1200
112. Задание {{ 745 }} ТЗ № 150
Константа скорости реакции повышается с:
1 понижением энергии активации
2 понижением температуры
3 повышением температуры
4 повышением концентрации
113. Задание {{ 746 }} ТЗ № 151
Влияние температуры на скорость в диффузионной области:
1 меньше, чем в кинетической 2 больше, чем в кинетической
115. Задание {{ 748 }} ТЗ № 153
С повышением температуры в обратимых экзотермических процессах:
1 повышается константа равновесия
2 снижается равновесный выход
3 уменьшается константа равновесия
4 повышается равновесный выход
116. Задание {{ 749 }} ТЗ № 154
Повышение температуры в эндотермических обратимых процессах приводит к:
1 повышению константы скорости
2 повышению константы равновесия
3 понижению константы скорости
4 понижению константы равновесия
117. Задание {{ 750 }} ТЗ № 155
Повышение температуры ограничивается:
1 термостойкостью конструктивных материалов
2 энергией активации
3 константой скорости
4 энергетическими затратами
119. Задание {{ 753 }} ТЗ № 158 Скорость процесса при прямотоке:
1 одинакова во всем объеме реактора
2 различна в различных точках аппарата
3 высокая в начале процесса
4 высокая в конце процесса
120. Задание {{ 754 }} ТЗ № 159
Повышение движущей силы процесса может быть достигнуто:
1 повышении концентрации реагентов
2 понижением давления в жидкофазном процессе
3 понижением концентрации исходных реагентов
4 повышением давления в газофазных процессах
123. Задание {{ 757 }} ТЗ № 162
Усиление перемешивания в гомогенных процессах будет способствовать:
1 выравниванию концентраций исходных веществ
2 уменьшению числа столкновений реакционных молекул
3 увеличению числа столкновений реакционных молекул
4 снижению концентраций исходных веществ
124. Задание {{ 758 }} ТЗ № 163
Увеличение поверхности соприкосновения фаз в системе газ-жидкость, может быть достигнуто при:
1 пленочной массопередаче
2 перемешивании
3 разбрызгивании жидкости
4 барботаже газа
125. Задание {{ 759 }} ТЗ № 164
Увеличение поверхности соприкосновения фаз в системе газ-твердое, может быть достигнуто:
1 конденсацией
2 измельчением твердого материала
3 распылением мелкодисперсного материала
4 перемешиванием во "взвешанном" слое
126. Задание {{ 760 }} ТЗ № 165
Увеличения поверхности соприкосновения фаз в системе 2-х несмешивающихся жидкостей может быть достигнуто:
1 перемешиванием
2 барботажем
3 диспергированием
4 нагревании
137. Задание {{ 771 }} ТЗ № 176
Скорость реакций газовых компонентов пропорциональна:
1 концентрации в степени, равной порядку реакции
2 температуре в степени, равной порядку реакции
3 давлению
4 величине давления в степени, равной порядку реакции
138. Задание {{ 772 }} ТЗ № 177
Повышение давления в газовой фазе:
1 уменьшает объем газовой фазы
2 повышает концентрацию компонентов
3 повышает объем газовой фазы
4 понижает концентрацию компонентов
139. Задание {{ 773 }} ТЗ № 178
Общий порядок реакции - это:
1 показатель степени у концентрации продукта
2 показатель степени у концентрации 1-го реагента
3 сумма показателей степеней у концентрации реагентов
4 сумма показателей степеней у концентрации продукта реагентов
142. Задание {{ 776 }} ТЗ № 181
Скорость реакции при перемешивании реагентов в гетерогенном процессе Ж-Ж:
1 увеличивается
2 уменьшается
3 не изменяется
4 уменьшается, а затем увеличивается
143. Задание {{ 777 }} ТЗ № 182
Константа скорости реакции при повышении температуры в химическом процессе:
1 повышается
2 не изменяется
3 снижается
4 увеличивается, а затем снижается
144. Задание {{ 778 }} ТЗ № 183
Степень превращения сырья, в обратимых гомогенных процессах, может достигать 100%, если процесс:
1 эндотермический
2 никогда не достигает 100%
3 экзотермический
4 газофазный и протекает с уменьшением обьема
145. Задание {{ 779 }} ТЗ № 184
 Скорость при повышении температуры в реакции А(ж)+В(ж) С(ж) – Q:
Скорость при повышении температуры в реакции А(ж)+В(ж) С(ж) – Q:
1 увеличивается
2 уменьшается
3 не изменяется
4 уменьшается, а затем увеличивается
146. Задание {{ 780 }} ТЗ № 185
Увеличить движущую силу в гомогенном жидкофазном процессе можно:
1 увеличивая давление в реакторе
2 применяя концентрированное сырье
3 понижая давление
4 повышая температуру
147. Задание {{ 781 }} ТЗ № 186
Увеличить движущую силу необратимого процесса в гетерогенной системе Г-Т можно:
1 используя обогащенное сырье
2 используя катализатор
3 понижая температуру
4 понижая давление
148. Задание {{ 782 }} ТЗ № 187
Увеличение поверхности контакта фаз, при проведении гетерогенного процесса Г-Ж, достигается:
1 обогащением твердой фазы
2 применением аппарата пленочного типа
3 повышением температуры процесса
4 понижением температуры процесса
149. Задание {{ 783 }} ТЗ № 188
Увеличение поверхности соприкосновения между твердой фазой и газом (Г-Т):
1 создание большой поверхности твердой фазы
2 применения катализатора
3 повысить дисперсность материала
4 измельчением твёрдого материала
150. Задание {{ 784 }} ТЗ № 189
 Скорость химической реакции А(газ)+В(газ) С(газ) – Q увеличивается, если:
Скорость химической реакции А(газ)+В(газ) С(газ) – Q увеличивается, если:
1 повышать температуру
2 понижать температуру
3 повышать давление
4 понижать давление
151. Задание {{ 785 }} ТЗ № 190
Повышение температуры в гомогенном необратимом некаталитическом процессе:
1 уменьшает скорость
2 не влияет на скорость
3 снижает выход продукта
4 увеличивает его скорость
152. Задание {{ 786 }} ТЗ № 191
Повышения давления в газофазном некаталитическом необратимом процессе:
1 снижает его скорость
2 увеличивает скорость
3 не влияет на скорость
4 увеличивает производственные потери
153. Задание {{ 787 }} ТЗ № 192
Увеличить скорость гетерогенного процесса, протекающего в диффузионной области, можно:
1 интенсифицированием диффузионных процессов в реакторе
2 увеличением концентрации реагентов
3 применением катализатора
4 увеличением температуры в зоне реакции
154. Задание {{ 788 }} ТЗ № 193
Повышение давления в жидкофазном необратимом некаталитическом процессе:
1 снижает скорость
2 не влияет на скорость
3 снижает степень превращения сырья
4 увеличивает его скорость
155. Задание {{ 789 }} ТЗ № 194
Присутствие катализатора в химическом реакторе:
1 изменяет тепловой эффект химической реакции
2 увеличивает скорость химической реакции
3 изменяет давление
4 изменяет агрегатное состояние реагентов
156. Задание {{ 790 }} ТЗ № 195
 Перемешивание реагентов, при проведении реакции А(жид)+В(тв.) С(жид) + Q, приводит к:
Перемешивание реагентов, при проведении реакции А(жид)+В(тв.) С(жид) + Q, приводит к:
1 увеличению скорости реакции
2 уменьшению скорости реакции
3 не изменяет скорость реакции
4 изменению агрегатного состояния реагентов
Дата публикования: 2015-10-09; Прочитано: 1974 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
