 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Зависимость скорости реакции от концентрации реагентов
|
|
Математические выражения, описывающие скорости химических реакций, называются кинетическими.
Пусть идет реакция А + В → продукты реакции.
Чтобы молекулы прореагировали друг с другом, они должны войти в контакт, столкнуться. Рассмотрением столкновений молекул при реакциях занимается теория столкновений,которая позволяет разобраться в механизме протекания химических реакций. В соответствии с теорией столкновений скорость протекания реакций определяется двумя факторами: 1) числом столкновений между частицами реагентов (ионами, атомами или молекулами) в единицу времени; 2) долей столкновений, которые эффективно приводят к химическому взаимодействию. Роль первого фактора довольно очевидна: чем больше концентрация реагентов, тем больше вероятность столкновений между реагирующими молекулами. Но не все столкновения приводят к образованию продуктов. Доля эффективных столкновений определяется природой реагентов и температурой процесса. Поскольку скорость реакции определяется числом возможных столкновений между молекулами А и В, то можно записать кинетическое уравнение
υ = k∙ [А]∙ [B],
где [А], [В] - молярные концентрации веществ А и В соответственно; k - константа скорости реакции,важная величина, зависящая от природы реагирующих. Константа скорости реакции - это скорость химической реакции при концентрации реагирующих веществ, равных единице, т.е. [А] = [В] = 1 моль/дм3. Она не зависит от концентрации реагирующих веществ и для данной реакции при неизменной температуре - величина постоянная. Константа скорости реакции зависит от температуры и катализатора.
В общем случае для реакции, описываемой уравнением
аА + bВ + сС → продукты реакции,
выражение для скорости реакции имеет вид
υ = k∙ [А]а∙[В]b∙[С]С
Таким образом, скорость реакции пропорциональна произведению молярных концентраций реагентов в степени равной стехиометрическим коэффициентам в уравнении реакции.Это утверждение высказаноК. Гульдбергом и П. Вааге в 1867 г. и называется законом действия масс, или законом Гульдберга и Вааге.
17.Скорость реакции характеризуют изменением концентрации какого-либо из исходных или конечных продуктов реакции в функции времени. Различают среднюю скорость реакции в интервале времени и истинную скорость реакции в определенный момент времени. Если в интервале времени t1 и t2 концентрация одного из исходных веществ или продуктов реакции равна соответственно с1 и с2, то среднюю скорость реакции (v) в интервале времени t1 и t2 можно выразить:

Поскольку речь идет в данном случае об убыли концентрации исходного вещества, т.е. изменение концентрации вещества берется в этом случае со знаком «минус» (-). Если скорость реакции оценивается изменением (увеличением) концентрации одного из продуктов реакции, то со знаком «плюс» (+):

Из уравнения Аррениуса для k видно, что, поскольку Т входит в показатель степени, скорость химической реакции очень чувствительна к изменению температуры. Зависимость скорости гомогенной реакции от температуры может быть выражена правилом Вант-Гоффа, согласно которому при увеличении температуры на каждые 10° скорость реакции возрастает в 2-4 раза; число, показывающее во сколько раз возрастает скорость данной реакции при повышении температуры на 10°, называется температурным коэффициентом скорости реакции - γ.

где k - константа скорости при температуре t °C. Зная величину γ, можно рассчитать изменение скорости реакции при изменении температуры от T1 до T2 по формуле:

При повышении температуры в арифметической прогрессии скорость возрастает в геометрической.
18.Энергия активации элементарной реакции Е – это минимальный избыток энергии над средней внутренней энергией молекул, необходимый для того, чтобы произошло химическое взаимодействие (энергетический барьер, который должны преодолеть молекулы при переходе из одного состояния реакционной системы в другое).
Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:
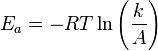 ,
,
где k — константа скорости реакции,  — фактор частоты для реакции,
— фактор частоты для реакции, 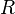 — универсальная газовая постоянная,
— универсальная газовая постоянная, 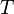 — температура в кельвинах.
— температура в кельвинах.
С повышением температуры растёт вероятность преодоления энергетического барьера.
Для количественного описания температурных эффектов в химической кинетике для приближённых вычислений кроме уравнения Аррениуса используют правило Вант-Гоффа: повышение температуры на 10 К увеличивает для большинства реакций скорость в 2-4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом:

где  — температурный коэффициент скорости (его значение лежит в интервале от 2 до 4). Правило Вант-Гоффа является весьма грубым и применимо только в очень ограниченном интервале температур: от 10 до 400 ˚С, а также при энергии активации от 60 до 120 кДж/моль. Правило Вант-Гоффа не работает с крупными молекулами.
— температурный коэффициент скорости (его значение лежит в интервале от 2 до 4). Правило Вант-Гоффа является весьма грубым и применимо только в очень ограниченном интервале температур: от 10 до 400 ˚С, а также при энергии активации от 60 до 120 кДж/моль. Правило Вант-Гоффа не работает с крупными молекулами.
19.Химическим реактором называется аппарат, в котором осуществляются химические процессы, сочетающие химические реакции с массо- и теплопереносом. Типичные реакторы – промышленные печи, контактные аппараты, реакторы с механическим или струйным перемешиванием, варочные котлы и др. От правильности выбора реактора и его совершенства зависит эффективность всего технологического процесса.
Основные требования к промышленным реакторам:
1. максимальная производительность и интенсивность работы;
2. высокий выход продукта и наибольшая селективность процесса. Они обеспечиваются оптимальным режимом работы реактора:(температурой, давлением, концентрацией исходных веществ; для каталитических процессов – эффективным применением катализатора);
3. минимальные энергетические затраты на перемешивание и транспортировку материалов через реактор, а также наилучшее использование теплоты экзотермических реакций или теплоты, подводимой в реактор для нагрева реагирующих веществ до оптимальных температур (затраты снижаются уменьшением скоростей потоков, числом оборотов мешалки, но при этом, уменьшается и интенсивность работы реактора, степень превращения);
4. легкая управляемость и безопасность работы обеспечивается конструкцией реактора и малыми колебаниями параметров технологического режима, позволяющими легко автоматизировать работу реактора;
5. низкая стоимость изготовления реактора и ремонта его (простота конструкции и применение дешевых конструкционных материалов);
6. устойчивость работы при значительных изменениях основных параметров режима (концентрации, температуры, давления и др.).
При проектировании реактора необходимы сведения о кинетических закономерностях химической реакции и производительности. Разрабатывая схему реактора, технолог решает – будет реактор работать непрерывно или периодически, определяет модель реактора и указывает способы подвода и отвода тепла.
Методы технологического расчета и подбора параметров значительно отличаются для различных типов реакторов. Поскольку гидродинамическая обстановка и температурный режим в основном определяют кинетику процесса, протекающего в реакторе, в основу классификации реакторов положены предельные гидродинамические режимы: идеального вытеснения и полного (идеального) смешения в изотермических, адиабатических или политермических условиях. Эта идеализация позволяет исключить из рассмотрения второстепенные черты процесса и использовать те, которые определяют поведение системы.
Расчет промышленного реактора в большей степени базируется на экспериментальных данных и идеализированные модели служат лишь отправной точкой для наиболее полного использования опытных данных для определения основных размеров реактора. При исследовании работы реакторов составляется математическое описание (математическая модель) реактора. Уравнения математической модели выводятся на основании балансов веществ теплоты и количества движения для реактора в целом или для его бесконечно малого объема в зависимости от его режима работы.
20.Классификация химических реакторов. По принципу организации процесса химическая реакционная аппаратура может быть разделена на три группы:
— реактор непрерывного действия;
— реактор периодического действия;
— реактор полунепрерывного (полупериодического) действия.
По гидродинамическому режиму различают следующие типы:
— реактор вытеснения непрерывного действия (РВНД);
— реактор смешения непрерывного действия (РСНД);
— реактор промежуточного типа (с промежуточным гидродинамическим режимом).
По тепловому режиму работы реакторы делят на следующие типы:
— изотермический;
— адиабатический;
— подтропический.
21.Химико-технологический процесс (ХТП) - совокупность операций позволяющих получить целевой продукт заданного количества и качества из исходного сырья. ХТП, как правило, складывается из элементарных процессов (стадий):
- подвод реагирующих компонентов в зону реакции;
- химической реакции;
- отвода полученного продукта.
Подвод реагирующих компонентов в зону реакции совершается молекулярной диффузией или конвекцией. При сильном перемешивании реагирующих веществ конвективный перенос называется турбулентной диффузией. В многофазных системах подвод реагирующих систем может осуществляться абсорбцией или десорбцией газов, конденсацией паров, плавлением твердых веществ или растворением их в жидкости, испарением жидкости или возгонкой твердых веществ.
В реагирующих системах обычно происходит несколько последовательных химических реакций, приводящих к образованию нового целевого продукта, а также ряд побочных реакций между основными веществами и примесями наличие которых в исходном материале неизбежно.
Отвод полученного продукта может совершаться также, как и подвод реагирующих компонентов, путем диффузии, конвекции и перехода вещества из одной фазы в другую.
Общую скорость технологического процесса может лимитировать скорость одного из элементарных процессов. Если наиболее медленно идут химические реакции, то говорят, что процесс идет в кинетической области, и стремятся усилить те факторы, которые влияют на скорость реакции (температура, катализаторы, увеличение концентраций исходных веществ и др.). Если общую скорость лимитирует подвод реагентов или отвод продуктов, то говорят, что процесс протекает в диффузионной области. Увеличение диффузионной скорости обеспечивает: более интенсивное перемешивание; увеличение температур, концентраций; перевод реагирующих систем из многофазной в однофазную.
Если скорости всех элементарных составляющих ХТП соизмеримы, то процесс протекает в переходной области и по этому необходимо воздействовать факторами которые ускоряют как диффузию так и химическую реакцию.
Анализ единичных процессов, проводимых в конкретных аппаратах, учет их взаимосвязей позволяет разработать оптимальный технологический режим ХТП.
Дата публикования: 2015-10-09; Прочитано: 775 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
