 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Промышленные процессы получения серной кислоты
|
|
8.3.1. Получение серной кислоты из серного колчедана. Технологическая схема производства серной кислоты из серного колчедана включает три стадии: а) обжиг серного колчедана с получением SO2; б) контактирование SO2 с кислородом; в) абсорбция SO3.
Обжиг серного колчедана. Это гетерогенный высокотемпературный (до 1000 о С), необратимый каталитический процесс, включающий ряд стадий. Основная реакция протекает по схеме
4FeS2 +11O2 = 2FeO3 + 8SO2 + 3420 кДж/ моль. (9.7)
При недостатке кислорода протекает иная реакция
3FeS2 + 8O2 = Fe3O4 + 6SO2 + 2440 кДж/ моль. (9.8)
При окислении сульфида железа на поверхности зерна минерала полу-чается слой оксидов, толщина которого растет по мере выгорания серы из минерала. Общая скорость процесса при этом определяется скоростью диф-фузии газов в порах этого слоя оксидов. Следовательно, процесс обжига кол-чедана протекает во внутридиффузионной области. Скорость процесса в целом описывается уравнением
 = k · F ·
= k · F ·  (9.9)
(9.9)
Из уравнения (9.9) следует, что скорость процесса можно увеличить путем повышения коэффициента массопередачи k, для чего эффективнее всего поднимать температуру. Но при 850–1000 о С материал в печи спекается и резко снижается реакционная поверхность F. Поэтому температура процесса определяется химическим составом и природой колчедана, а также конструкцией печи.
Для увеличения движущей силы процесса  С повышают концентрацию пирита в колчедане и кислорода в зоне обжига путем флотации руды, а кислорода – применением избытка воздуха, в 1,5–2 раза превышающего стехиометрическое.
С повышают концентрацию пирита в колчедане и кислорода в зоне обжига путем флотации руды, а кислорода – применением избытка воздуха, в 1,5–2 раза превышающего стехиометрическое.
Для повышения поверхности соприкосновения фаз флотационный кол-чедан измельчают до размеров частиц 0,3–0,03 мм.
Совершенствование технологии обжига колчедана шло от применения механических полочных печей к печам пылевидного обжига и далее к современным печам с кипящим слоем колчедана (ПКС), которые практически вы-теснили все остальные типы печей. Сравнительную эффективность эксплуатации различных реакторов обжига колчедана иллюстрирует табл. 9.1.
Таблица 9.1
| Тип реактора обжига колчедана | Интенсивность работы реактора, кг/м3 · сутки | Доля SO2 в обжиговом газе, % об. | Доля серы в огарке, % масс. |
| Многополочный реактор | |||
| Реактор пылевидного обжига | 700–1000 | 1–1,5 | |
| Реактор кипящего слоя | 1000–1800 | 0,5 |
 ПКС представляет собой цилиндрическо-коническую камеру, в нижней части которой установлен газораспределительная решетка, на которую непрерывно поступает обжиговый материал. Под решетку подается воздух со скоростью, обеспечивающей переход частиц во взвешенное состояние, но недостаточную для выноса частиц материала из печи. Производительность таких печей в 10 раз выше, чем любых других и составляет 1800 кг / м3 реакционного объема в сутки. При этом получают газ, содержащий до 14 % SO 2. Теплоту реакции используют для выработки пара путем помещения в зону реакции теплообменных элементов, в которые подают воду, а получают пар. Производительность по пару составляет 1,3 т / т колчедана.
ПКС представляет собой цилиндрическо-коническую камеру, в нижней части которой установлен газораспределительная решетка, на которую непрерывно поступает обжиговый материал. Под решетку подается воздух со скоростью, обеспечивающей переход частиц во взвешенное состояние, но недостаточную для выноса частиц материала из печи. Производительность таких печей в 10 раз выше, чем любых других и составляет 1800 кг / м3 реакционного объема в сутки. При этом получают газ, содержащий до 14 % SO 2. Теплоту реакции используют для выработки пара путем помещения в зону реакции теплообменных элементов, в которые подают воду, а получают пар. Производительность по пару составляет 1,3 т / т колчедана.
По технологическому оформлению производство серной кислоты из железного колчедана является очень сложным и включает ряд блоков, где последовательно проводят необходимые стадии процесса.
Структурная схема такого производства приведена на рис. 9.4.
I II III





 пирит вода абсорбент 2 3 4 5 6 7
пирит вода абсорбент 2 3 4 5 6 7








 1
1

пар хвостовые
 воздух Н2SO4 газы
воздух Н2SO4 газы
 огарок
огарок
Рис. 9.4. Структурная схема производства серной кислоты из колчедана
Римскими цифрами на схеме обозначено: I – блок получения обжигового газа; II – блок контактирования; III – блок абсорбции.
Арабскими цифрами на схеме обозначены следующие операторы: 1 – обжиг колчедана; 2 – охлаждение обжигового газа в котле-утилизаторе; 3 – общая очистка газа; 4 – специальная очистка газа; 5 – подогрев контактируемого газа в теплообменнике; 6 – контактирование оксида серы (IV) с кислородом; 7 – абсорбция оксида серы (VI).
Контактный способ производства серной кислоты. Этот способ после получения диоксида серы включает еще 3 стадии:
- очистку газа от вредных для катализатора примесей;
- контактное окисление SO 2 в SO 3;
- абсорбцию SO 3 серной кислотой.
Очистка газа. От огарковой пыли газ очищают в циклонах, а затем, после использования теплоты газа, в сухих электрофильтрах. После ПКС доля пыли в газах составляет 200 г/м3, циклона – 20 г/м3, фильтров – 0,1 г/м3 .
Для полного освобождения газа от остатков пыли и более полного отделения от оксидов мышьяка и селена, являющихся каталитическими ядами, необратимо отравляющих катализатор, очистку ведут в промывных башнях серной кислотой концентрацией 93–95 %, а затем турбокомпрессором подают в контактное отделение для окисления диоксида серы.
Контактное окисление диоксида серы. Это основная стадия процесса производства серной кислоты. Является типичным примером гетерогенного экзотермического каталитического процесса.
2SO2 +O2 = 2SO2 + 189 кДж / моль (при 500 оС). (9.10)
Согласно принципу Ле-Шателье, равновесие в этой реакции должно сдвигаться вправо при повышении давления и снижении температуры. На практике давление не повышают из-за небольших концентраций диоксида серы и кислорода в обжиговом газе (80 % азота).
Рост энергетических затрат при повышении давления превышает выгоду от этого приема. Константа равновесия в этой реакции равна
Кр = 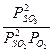 (9.11)
(9.11)
или
 =
= 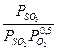 , (9.12)
, (9.12)
где: PSO 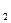 ,
,  PSO
PSO 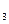 , PO
, PO 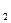 – парциальные равновесные давления SO 2, SO 3 и О2. Равновесная степень превращения SO 2 в SO 3
– парциальные равновесные давления SO 2, SO 3 и О2. Равновесная степень превращения SO 2 в SO 3
X р = 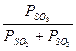 (9.13)
(9.13)
или после преобразований
X P =  (9.14)
(9.14)
или через концентрации
ХР = 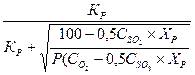 . (9.15)
. (9.15)
Зависимость равновесной степени превращения от состава контактирующих газов при давлении 0,1 МПа и 475 о С приведена в табл. 9.2.
Таблица 9.2
Влияние параметров процесса на степень превращения SO2 в SO3
| Доля SO2, % | |||||||
| Доля О2, % | 18,2 | 14,1 | 12,7 | 11,3 | 10,0 | 8,6 | 7,2 |
| Хр , % | 97,1 | 96,5 | 96,2 | 95,8 | 95,2 | 94,3 | 92,3 |
Как следует из табл. 9.2, степень превращения SO 2 в SO 3 находится в обратной зависимости от его концентрации. Но при низких концентрациях диоксида серы мала производительность процесса. Поэтому оптимальным считается газ, доля SO 2 в котором составляет 7–9 %, О 2 – 10–11 %.
Зависимость выхода SO3 от температуры процесса при С SO 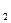 = 7 %; C O
= 7 %; C O 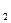 = 11 % представлена на графике (рис. 9.5):
= 11 % представлена на графике (рис. 9.5):

| |||||
400 500 600 700 800 900 1000
Температура, оС
Рис. 9.5. Зависимость выхода SO3 от температуры процесса
Как видно из графика, наибольший выход SO 3 (99,2 %) достигается при минимальной температуре (400 о С). Однако при низких температурах мала скорость процесса и, следовательно, производительность процесса. Поэтому при работе на современных ванадиевых катализаторах окисление проводят в несколько стадий с постепенным снижением температуры от 580–600 о С – на первой стадии и до 400–450 о С – на последней.
Скорость процесса окисления SO 2 определяется в первую очередь активностью катализатора, а также параметрами процесса.
История развития процесса каталитического окисления SO 2 в SO 3 знает применение трех катализаторов: Pt, Fe2O3 и V2O5. Наиболее активна платина, но она дорога и подвержена необратимым отравлениям даже следами мышьяка и селена. Fe2O 3 не отравляется мышьяком и селеном, но активен при высоких температурах (выше 625 оС), т.е. тогда, когда равновесная степень превращения равна менее 70 % и поэтому применяется лишь для предварительного контактирования до Х = 50–60 %.
Ванадиевые катализаторы с содержанием V2O 5 до 7 % – наиболее оптимальные. Они включают в качестве промотора К2О. Катализатор наносят на высокопористые носители – алюмосиликаты. Гранулы катализатора имеют размер не более 1,5 мм и хорошо противостоят диффузионному торможению внутри пор катализатора. Однако мелкие гранулы создают большое гидравлическое сопротивление и поэтому применяют зерна размером 5 мм.
На любом катализаторе степень превращения SO 2 возрастает во времени, приближаясь к равновесной по затухающей кривой. Чем выше температура, тем быстрее достигается состояние равновесия и тем ниже равновесный выход. Кинетическое уравнение процесса окисления SO 2 в SO 3 выведено Г.К. Боресковым и описывается следующим образом:
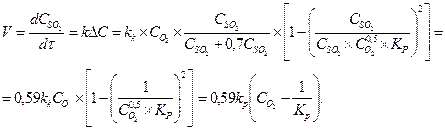 (9.16)
(9.16)
Как видно из данного уравнения, наибольшее влияние на изменение концентрации оказывает концентрация кислорода.
На рис. 9.6 представлена зависимость степени окисления SO 2 от времени контакта при различных температурах и давлении 0,1 МПа.
  2 2
| |||||
 
| 
| ||||

| |||||
0 0,5 1,0 1,5 2,0 2,5 3, 0
Время, с
Рис. 9.6. Влияние температуры и времени контакта
на степень окисления SO2 в SO3 на ванадиевом катализаторе
(CSO 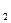 = 7 %, CSO
= 7 %, CSO 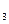 = 11 %, CN
= 11 %, CN 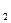 = 82 %)
= 82 %)
На рис. 9.6 обозначено: 1 – 425 оС; 2 – 475 оС; 3 – 600 оС.
Как показано в выше приведенных исследованиях, лимитирующей стадией катализа является сорбция О 2. Повышение концентрации кислорода увеличивает скорость процесса и возможную степень окисления. Но, повышая концентрацию кислорода, мы неизбежно снижаем концентрацию SO 2, что приводит к уменьшению производительности процесса. Кроме того, в силу того, что данная реакция экзотермична, повышение температуры сдвигает равновесие в сторону меньшего значения 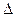 С и общей скорости процесса. С другой стороны, константа скорости реакции с повышением температуры повышается, согласно закону Аррениуса.
С и общей скорости процесса. С другой стороны, константа скорости реакции с повышением температуры повышается, согласно закону Аррениуса.
На основании изложенного можно заключить, что для достижения максимальной скорости процесса следует начинать его при более высоких температурах (600 о С), а затем снижать по кривой до 400 о С.
В реальных процессах подобная технология осуществляется в многополочных контактных аппаратах (см. рис. 9.7).



 SO2 SO2
SO2 SO2

 2
2
 |  |






 2
2
 | |||
 | |||









 2
2


 2
2
 |  |  |
 SO3 в абсорбер
SO3 в абсорбер
SO2 1
Рис. 9.7. Устройство многополочного контактного аппарата
1 – контактный аппарат; 2 – теплообменник
Полочные контактные аппараты хорошо себя зарекомендовали при длительной работе, но громоздки и металлоемки. Обычно это цилиндры диаметром 12 м и высотой 25 м. Производительность – 1000 т серной кислоты в сутки.
Катализатор служит в среднем четыре года. Оптимальные условия процесса создаются в контактных аппаратах кипящего слоя. В таких аппаратах применяют износостойкий шариковый ванадиевый катализатор с диаметром частиц 0,75–1,5 мм вместо 4–5 мм в аппаратах с фильтрующим слоем. В отличие от процесса со стационарным слоем катализатора, процесс с кипящим слоем катализатора протекает в кинетической области и обладает большей производительностью. В современных технологиях степень окисления SO 2 в SO 3 достигает 99 %.
Абсорбция оксида серы (VI). Процесс описывается реакцией:
SO3 + H2O = H2SO4 + 92 кДж / моль (9.17)
При этом наличие в газовой фазе даже небольших количеств воды приводит к образованию мельчайших капель H2SO4, которые образуют стойкий туман, плохо поглощаемый водой, кислотой и даже щелочью. Поэтому в газовой фазе, поступающей на абсорбцию, должны отсутствовать пары воды. Кроме того, парциальное давление паров воды над поглощающей жидкостью должно быть минимальным. Такому требованию наилучшим образом соответствует кислота, содержащая 98,3 % H 2 SO 4 (см. диаграмму кипения системы Н 2 О – SО 3). Такая кислота отличается ничтожным парциальным давлением как Н2О, так и SO 3, и практически полностью поглощает SO 3. При этом кислоту подают в таком избытке, чтобы ее концентрация за один цикл повы-шалась на 0,2 %. С кислотой отводится и теплота абсорбции.
После охлаждения лишь небольшая часть кислоты отбирается в виде готовой продукции, а основная часть после добавки воды или разбавленной кислоты возвращается на абсорбцию.
На рис. 9.8 показано влияние концентрации кислоты на скорость абсорбции.
 Vабс
Vабс


0 98,3 % Н2SO4
Рис. 9.8. Зависимость скорости абсорбции от концентрации серной кислоты
Схема двухстадийного процесса абсорбции представлена на рис. 9.9.






















































 SO3 5 выходящие моногидрат
SO3 5 выходящие моногидрат




 газы
газы



 3
3









 H2O
H2O

 2
2




 3 4
3 4


 1 Н2О
1 Н2О








 5
5











 Н2О
Н2О
 6 7
6 7
 олеум на склад кислота на склад
олеум на склад кислота на склад
Рис. 9.9. Схема двухстадийного процесса абсорбции SO3
На схеме обозначено: 1 – холодильник газа; 2 – олеумный абсорбер; 3 – моногидратный аппарат; 4 – сушильный барабан; 5 – холодильники жидкого продукта; 6, 7 – сборники олеума и моногидрата соответственно.
На представленной схеме на первой стадии абсорбции SO 3 и абсорбент (20 % олеум) охлаждают до 80 о С перед абсорбцией. На второй стадии в качестве сорбента используют моногидрат.
Полная технологическая схема производства серной кислоты контактным способом называют ДК – ДА (двойное контактирование – двойная аб-сорбция) является гораздо более сложной и включает следующие отделения:
- печное с сухой очисткой газа;
- промывное, в котором газ подвергают мокрой очистке от остатков пыли, сернокислотного тумана, контактных ядов и водяных паров;
- компрессорное;
- контактное;
- абсорбционное.
Производительность такой установки составляет до 1500 т / сутки по моногидрату. Расходные коэффициенты на 1 т моногидрата таковы: колчедан – 0,82 т, вода – 50 м 3, электроэнергия – 82 кВт · ч.
9.3.2. Технологическая схема производства серной кислоты из серы. Получение H2SO4 из элементарной серы представляет собой процесс, включающий стадии сжигания серы до SO2, контактирования полученного диоксида и абсорбцию трехоксида с получением товарной серной кислоты.
Горение серы – это гомогенная экзотермическая реакция, которой предшествует процесс перехода твердой серы в жидкое состояние с последующим ее испарением:
S + O2 = SO2 + 297 кДж/моль (9.18)
Поскольку в печном газе при сжигании серы отсутствуют пыль и каталитические яды, технология производства серной кислоты и серы не содержит отделение очистки газа, она отличается простотой, и получила название «короткой схемы» (рис. 9.10).






 пар вода
пар вода




























 сера 4 5 6 SO3
сера 4 5 6 SO3
 |  | ||||||||
 |  |  | |||||||





 пар
пар




























 вода
вода
 |  |  | |||||||||||||||
 |  |  |  |  |  | ||||||||||||












 1 2
1 2



 3 товарная
3 товарная


 Н2SO4
Н2SO4













 7 7
7 7






 воздух
воздух
 |  |
Рис. 9.10. Производство серной кислоты из серы
На схеме обозначено: 1 – камера плавленая серы; 2 – фильтр жидкой серы; 3 – печь сжигания серы; 4 – котел-утилизатор; 5 – контактный аппарат; 6 – система абсорбции оксида серы (VI); 7 – холодильник серной кислоты.
9.3.3. Производство серной кислоты из сероводорода. Способ получения серной кислоты из сероводорода получил название «мокрого катализа» (И.А. Ададуров, Д. Гернст, 1931 г.). Он состоит в том, что смесь диоксида серы и паров воды, полученная при сжигании сероводорода в токе воздуха, подается без предварительного разделения сразу на контактирование, где оксид серы (IV) окисляется на твердом ванадиевом катализаторе до оксида серы (VI). Затем газовая смесь охлаждается в холодильнике-конденсаторе, где пары образующейся серной кислоты превращаются в жидкий продукт.
Таким образом, в отличие от других способов получения серной кислоты, в процессе мокрого катализа отсутствует стадия абсорбции оксида серы (VI) и весь процесс включает только три последовательные стадии.
1. Сжигание сероводорода по реакции:
Н2S + 1,5O2 = SO2 + H2O + 519 кДж/моль. (9.19)
2. Окисление оксида серы (IV) до оксида серы (VI):
SO2 +0,5O2 = SO3 + 96 кДж/моль. (9.20)
3. Конденсация паров и образование серной кислоты:
SО3 + H2O = H2SO4 + 92 кДж/моль. (9.21)
Таким образом, процесс мокрого катализа описывается суммарным уравнением:
H2S + 2O2 = H2SO4 + 707 кДж/моль. (8.22)
В качестве сырья в процессе мокрого катализа применяют сероводородный газ, содержащий до 90 % H2S, как правило, являющийся отходом некоторых производств в металлургии, нефтепереработке, нефтехимии и т.д.
Технологическая схема этого процесса имеет следующий вид (рис. 9.11):



 воздух
воздух









 - отход.
- отход.








 Н2S газы
Н2S газы
 |  |  |  |  |











 4 6
4 6






 вода +
вода +
 |  |  | |||||||||
 |  |  | |||||||||











 1 вода
1 вода
 |  |  |

 2 пар 3 5
2 пар 3 5
кислота на склад
Рис. 9.11. Производство серной кислоты из сероводорода
На рис. 9.11 обозначено: 1 – печь с огнеупорной насадкой; 2 – котел-утилизатор; 3 – контактный аппарат; 4 – башня-конденсатор; 5 – холодильник; 6 – электрофильтр.
Так как газ при выделении подвергается промывке, то он не нуждается в стадии очистки, а продукты его сжигания не содержат вредных примесей и тоже не требуют очистки.
На данной схеме поступающий в печь H2S сжигают при большом избытке воздуха для избежания перегрева от избытка выделяющегося тепла. Полученную в результате сжигания H2S газовую смесь охлаждают в котле-утилизаторе с 1000 до 400 о С и подают в контактный аппарат. Перед подачей газовой смеси в контактный аппарат ее разбавляют воздухом до оптимального состава реакционной смеси. Контакт реакционного газа с катализатором осуществляется на четырех уровнях, причем на каждом уровне контакта вводится дополнительное количество воздуха для термостатирования процесса. После контактного аппарата конвертированный газ охлаждают в башнях орошения серной кислотой с образованием товарной H2SО4 и сернокислотного тумана, улавливаемого в электрофильтрах.
В этом процессе получают серную кислоту концентрацией 96 % при ее выходе на прореагировавший сероводород до 97 %. Производительность установки 300 т /сутки по моногидрату.
В табл. 9.3. приведены данные по товарным сортам серной кислоты.
Таблица 9.3
Дата публикования: 2015-10-09; Прочитано: 1199 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
