 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры аналитического решения математической модели (8.22) и (8.23) для частных случаев
|
|
k
 1. Простая элементарная реакция А R. Скорость такой реакции описывается выражением wr,А = kсА. Подставляем это выражение в уравнение (8.22) и получим:
1. Простая элементарная реакция А R. Скорость такой реакции описывается выражением wr,А = kсА. Подставляем это выражение в уравнение (8.22) и получим:
 =
=  . (8.24)
. (8.24)
Проинтегрируем выражение (8.24) и получим время пребывания реагента в реакторе:
 =
=  . (8.25)
. (8.25)
Тогда концентрация реагента на выходе из реактора равна:
сА = сА,0  (8.26)
(8.26)
и степень превращения реагента А составит:
хА = 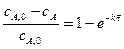 . (8.27)
. (8.27)
k1

 2. Обратимая реакция А R. Зададимся дополнительным условием,
2. Обратимая реакция А R. Зададимся дополнительным условием,
k 2
что cR,0 = 0. Тогда:
wr,А = k1сА – k2сR = (k1 + k2) сА – k2cA,0. (8.28)
Подставив (8.28) в (8.24), получим время пребывания реагента в реакторе:
 =
=  . (8.29)
. (8.29)
Из (8.29) после преобразований получим концентрацию реагента на выходе из реактора:
сА = 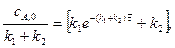 (8.30)
(8.30)
и степень превращения реагента А составит:
хА =  (8.31)
(8.31)
 k1 R
k1 R
 2. Параллельная реакция А k2. Для такой реакции скорость по
2. Параллельная реакция А k2. Для такой реакции скорость по
S
компоненту А имеет вид wr,А = (k1 + k2) сА и выражения для сА и хА будут:
сА = сА,0  (8.32)
(8.32)
и
хА =  . (8.33)
. (8.33)
Выражение скорости по компоненту R имеет вид:
wr,А =  = – k1сА = wr,А = – k1сА,0
= – k1сА = wr,А = – k1сА,0  (8.34)
(8.34)
или
d cR = – k1сА,0  d
d  (8.35)
(8.35)
Интегрируя левую часть (8.35) в пределах от cR,0 до cR, а правую – от нуля до  , получим концентрацию реагента R на выходе из реактора:
, получим концентрацию реагента R на выходе из реактора:
cR = 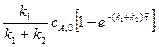 (8.36)
(8.36)
Аналогично находим концентрацию реагента S на выходе из реактора:
cS =  (8.37)
(8.37)
Дата публикования: 2015-10-09; Прочитано: 447 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
