 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Классификация химических реакций. Как было сказано выше, химический процесс составляет главную под-систему – химического превращения сырья
|
|
К ак было сказано выше, химический процесс составляет главную под-систему – химического превращения сырья. Он протекает в одну или нес-колько химических реакций, сопровождаемых явлениями массо- и теплообмена. Если процесс химического превращения протекает в одну стадию в соответствии со стехиометрическим уравнением, то его называют простым. Остальные реакции являются сложными. К ним можно отнести обратимые, цепные, параллельные, последовательные, сопряженные и другие реакции. Химические реакции классифицируются по ряду признаков:
- по фазовому состоянию реакционной системы(гомофазное или гете-рофазное);
- по месту протекания реакции на гетерогенные (протекают в объеме одной фазы) и гомогенные (протекают на поверхности раздела фаз);
- по механизму взаимодействия;
- по обратимости (обратимые и необратимые);
- по знаку теплового эффекта [ экзотермические (– 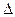 Н) и эндотерми-ческие (+
Н) и эндотерми-ческие (+ 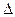 Н)];
Н)];
- по наличию катализатора (каталитические и некаталитические );
- по температуре (низкотемпературные и высокотемпературные);
- по порядку реакции.
Ниже представлена таблица 5.1 технологической классификации химических реакций.
Таблица 5.1
| Признак классификации | Примеры химических реакций |
| 1. Механизм и химизм реакции: - простая необратимая - простая обратимая - - с неблагоприятным равновесием - сложная необратимая - параллельная предыдущей - последовательная (консекутивная) - сложная обратимая |
2KClO3 =2KCl + 3O2 SO2 + 0,5O2 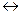 SO3
3H2 + N2 SO3
3H2 + N2 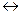 2NH3
NH3 + 1,25O2 = NO + 1,5H2O
2NH3 + 1,5O2 = N2 + 3H2O
С6Н5СН3 +О2 = С6Н5СН2ООН= С6Н5СНО +Н2О
СО + Н2О 2NH3
NH3 + 1,25O2 = NO + 1,5H2O
2NH3 + 1,5O2 = N2 + 3H2O
С6Н5СН3 +О2 = С6Н5СН2ООН= С6Н5СНО +Н2О
СО + Н2О 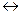 СО2 + Н2
СО + 2Н2 СО2 + Н2
СО + 2Н2 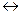 СН3ОН СН3ОН
|
| 2.Величина и знак теплового эффекта реакции: - сильноэкзотермическая - слабоэкзотермическая - сильноэндотермическая - слабоэндотермическая |
SO2 + 1,5O2 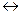 SO3 + 297 кДж/моль
С6Н12 SO3 + 297 кДж/моль
С6Н12 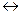 СН3(СН2)2СН=СН – СН3 +
циклогексан 2-гексен
59,9 кДж/моль
С6Н12 = С6Н6 + 3Н2 – 221 кДж/моль
ROH + R1COOH СН3(СН2)2СН=СН – СН3 +
циклогексан 2-гексен
59,9 кДж/моль
С6Н12 = С6Н6 + 3Н2 – 221 кДж/моль
ROH + R1COOH 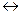 RCOOR1 + H2O – 50 кДж/моль RCOOR1 + H2O – 50 кДж/моль
|
| 3. Кинетическая модель–порядок реакции - нулевой - первый - второй - третий - дробный | Уравнение скорости реакции: – VA = kCA = k – VA = kCA – V = kCACB; – V = kC2A ; – V = kC2B – V = kC2ACB; – V = k CACB2 – V = kCACD1,5 |
| 4. Способ активации системы: влияние температуры реакции: - высокотемпературная (более 500 оС) - среднетемпературная (160–500 оС) - низкотемпературная (менее 160 оС) - реакция под давлением - реакции электрохимические, фотохимические и др. | Пиролиз углеводородного сырья Окисление парафинов Алкилирование изобутана олефинами Каталитический крекинг, каталитический риформинг, галогенирование парафинов |
В таблице обозначено: А, В – исходные реагенты; V – скорость реакции; k – константа скорости; С – концентрация.
Дата публикования: 2015-10-09; Прочитано: 355 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
