 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Параллельные реакции
|
|
Рассмотрим две параллельных реакции:
 (целевой продукт) (2.8 а)
(целевой продукт) (2.8 а)
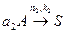 (побочный продукт) (2.8 б)
(побочный продукт) (2.8 б)
n1 и n2- порядок основной и побочной реакций.
Кинетические уравнения, которые описывают скорость превращения А в целевой 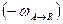 и в побочный продукт
и в побочный продукт  , имеют вид:
, имеют вид:
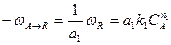 (2.9а)
(2.9а)
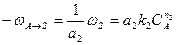 (2.9б)
(2.9б)
Отношение скорости расходования вещества А по целевой реакции к суммарной скорости расхода А по целевой и побочной реакции 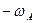 называют дифференциальной селективностью
называют дифференциальной селективностью 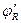
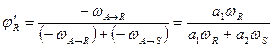 (2.10)
(2.10)
с учетом уравнений (2.9а) и (2.9б)
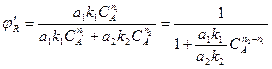 (2.11)
(2.11)
В общем случае по мере протекания процесса концентрация СА изменяется, так как 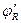 является переменной величиной, причем в зависимости от знака разностей n1- n2 дифференциальная селективность может быть и возрастающей и убывающей функцией от СА.
является переменной величиной, причем в зависимости от знака разностей n1- n2 дифференциальная селективность может быть и возрастающей и убывающей функцией от СА.
При расчете реакторов важно знать величину общей или интегральной селективности (избирательности) процесса 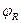 по целевому продукту R, которая представляет собой - отношение количества исходного реагента А которая расходуется на целевую реакцию
по целевому продукту R, которая представляет собой - отношение количества исходного реагента А которая расходуется на целевую реакцию 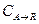 к общему количеству исходного реагента А израсходованному на реакцию.
к общему количеству исходного реагента А израсходованному на реакцию.
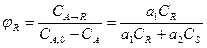 (2.12)
(2.12)
Величину СR можно выразить из уравнения (1.10)
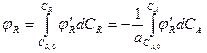 (2.13)
(2.13)
Подставляя (1.13) в (1.12), получим уравнение для определения общей селективности:
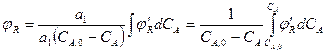 (2.14)
(2.14)
В реакторе идеального смешения СА одинаковая во всех точках реактора, поэтому для него  и для РИС-Н имеем
и для РИС-Н имеем  .
.
Часто при решении практических задач необходимо для реакторов разных типов знать связь между степенью превращения хА, селективностью φR и выходом целевого продукта ФR (отношением количества полученного продукта к его максимальному количеству, которое возможно получить в данных условиях.
Поскольку
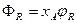 (2.15)
(2.15)
но при раскрытии значения общей селективности через дифференциальную для реакторов разных моделей получают разные выражения.
В РИС-Н  и уравнение (1.15) принимает вид:
и уравнение (1.15) принимает вид:
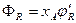 (2.15а)
(2.15а)
В РИВ φR рассчитывается по уравнению (2.14), тогда уравнение
(2.15) принимает вид:

Выражая  через
через 
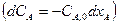 , при ε = 0 получаем:
, при ε = 0 получаем:

и окончательно для РИВ имеем:
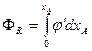 (2.15 б)
(2.15 б)
Пример 2.6
Определить объем РИВ и общую селективность по целевому продукту R на выходе из реактора при проведении параллельной реакции

что приводит к получению целевого продукта R и побочного продукта S.
Условия
Скорости образования продуктов R и S описываются следующими кинетическими уравнениями:
 кмоль/м3·сек
кмоль/м3·сек

Скорость подачи реагента В0 0,1 кмоль/мин
Суммарная концентрация реагентов на входе
в реактор (СА,0 + СВ,0) 20 кмоль/м3
Реагенты А и Во вступают в реакцию в
еквимолярных количествах.
Степень превращения реагента А, хА = 0,9
Решение
Дифференциальная селективность процесса по продукту R соответственно уравнению (2.11):

Общая селективность равняется (по уравнению 2.14):

Подставляя у это уравнение СА,0 = СВ,0 = 10 кмоль/м3, получаем

СА,К = СВ,К = СВ,0 (1 – хА) = 1 кмоль/м3
Таким образом, селективность по целевому продукту (φR) составляет 19%.
Объем реактора идеального вытеснения:
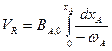 ,
,
где ВА,0 = 0,1 кмоль/мин = 1/600 кмоль/сек.
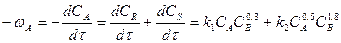

так как 

при СА,0 = СВ,0 и к1 = к2 = к
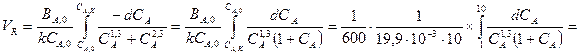


Значение интеграла определим графически (площадь S, ограниченная кривой  , осью абсцисс и прямыми СА = 1 и СА = 10).
, осью абсцисс и прямыми СА = 1 и СА = 10).
Данные для построения графика: (табл. 2.7.)
Таблица 2.7
| СА | 1+СА | lg СА | 1,3 lg СА | СА1,3 | [CA1,3(1+CA)]-1 |
| 0,500 | |||||
| 0,301 | 0,391 | 2,53 | 0,132 | ||
| 0,477 | 0,620 | 4,17 | 0,060 | ||
| 0,602 | 0,783 | 6,07 | 0,033 | ||
| 0,778 | 1,011 | 10,2 | 0,014 | ||
| 0,903 | 1,174 | 14,9 | 0,007 | ||
| 1,000 | 1,300 | 20,0 | 0,0045 |
VR = 0,0084 S = 0,0084 ּ 0,4923 = 0,0041 м3
Пример 2.6а
Определить объем РИВ и общую селективность по целевому продукту (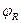 ) для процесса описанного в примере 2.6 который проводят в тех же условиях.
) для процесса описанного в примере 2.6 который проводят в тех же условиях.
Решение
Селективность:
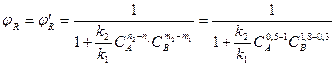
При к2 = к1 и СА,0 = СВ,0

Таким образом, селективность по целевому продукта (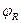 ) достигает 50%.
) достигает 50%.
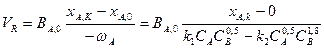
при к1 = к2; СА,0 = СВ,0
 м3
м3
Пример 2.7
Определить объем РИС-Н и селективность которую можно достичь по целевому продукту R при проведении параллельных реакций, описанных в примере
1.6, если процесс проводить с большим излишком вещества А для подавления побочной реакции.
Условия
В реактор поступает смесь исходных веществ, которая содержит 90 мл. % А и 10 мл. % В; СА,0 + СВ,0 = кмоль/м3
Мольная затрата вещества В ВВ,0 = 0,1 кмольּхв-1
Решение
СА,0 = 18 кмоль/м3; СА,К = 16,2 кмоль/м3
СВ,0 = 2 кмоль/м3 ; СВ,К = 0,2 кмоль/м3
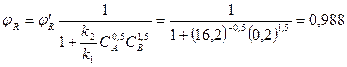


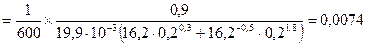 м3
м3
Результаты расчетов в примерах 2.5, 2.6,2.6а приведенные в табл. 2.8.
Таблица. 2.8
| Реактор | Начальное соотношение СА,0: СВ,0 | 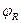 , % , %
|  , м3 , м3
|
| РОВ | 1:1 | 0,0045 | |
| БЫ | 1:1 | 0,0376 | |
| БЫ | 1:9 | 98,8 | 0,0074 |
Из табл. 2.8 видно, что более высокая селективность при еквимолярном соотношении реагентов может быть получена в реакторе идеального смешения. Однако при одной и тот же степени превращения реагента А реактор идеального смешения имеет объем больший (в рассмотренном примере в 9 раз), чем реактор идеального вытеснения.
Объем реактора идеального смешения можно уменьшить при изменении начального соотношения реагентов А и В.
Если один из реагентов взять в избытке, то суммарная скорость параллельных реакций заметно возрастает, что приводит к уменьшению объема реактора (при сохранении тот же степени превращения по реагенту, взятому в недостатке). Одновременно при этом возрастает 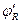 .
.
Дата публикования: 2015-10-09; Прочитано: 1202 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
