 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Пример 1. Рассчитать ΔН° для реакции разложения метана при температуре Т = 1000 К по реакции СН4 = С + 2Н2
|
|
Рассчитать Δ Н ° для реакции разложения метана при температуре Т = 1000 К по реакции СН4 = С + 2Н2.
Решение. Согласно справочным данным, Δ Н 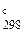 для данной реакции составляет +74 955 Дж.
для данной реакции составляет +74 955 Дж.
Уравнения молярных теплоемкостей имеют следующий вид:
С рм графит = 17,20 + 4,27 × 10-3 Т -  ;
;
С рм водород = 29,12 – 1,92 × 10-3 Т + 4,02 × 10-6 Т 2 - 0,88 × 10-9 Т 3;
С рм метан = 19,90 + 50,28 × 10-3 Т + 12,70 × 10-6 Т 2 - 11,02 × 10-9 Т 3.
Разности коэффициентов составят:
Δ а = 17,20 + 2 × 29,12 – 19,90 = 55,54;
Δ b = (4,27 – 2 × 1,92 – 50,28) × 10-3 = -42,17 × 10-3;
Δ с ' = -8,80 × 105;
Δ с = (2 × 4,02 – 12,70) × 10-6 = -4,66 × 10-6;
Δ d = [2 × (-0,88) + 11,02] × 10-9 = 9,26 × 10-9.
Найденные значения Δ а, Δ b, … и Т = 298 К, а также стандартную энтальпию используем в уравнении (47), чтобы рассчитать постоянную интегрирования:
74 955 = I1 + 55,54 × 298 - 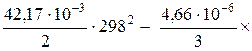

Постоянная интегрирования I1 = 13 776.
Искомое значение энтальпии реакции при температуре 1000 К находим по уравнению (47):
Δ Н 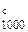 = 13 776 + 13,254 × 1000 -
= 13 776 + 13,254 × 1000 - 
 Дж.
Дж.
Количество выделившейся (или поглощенной) теплоты при протекании химической реакции зависит от степени превращения исходного реагента х А и значения теплового эффекта (изменения энтальпии):
Q х. р = Q х А n А,
где n А – химическое количество исходного реагента, моль (кмоль); Q – тепловой эффект реакции.
Исходя из вышеизложенного, уравнение теплового баланса будет иметь следующие составляющие:
Q исх = n А С рм А(Т А – Т 0);
Q х. р= QТ 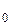 x А n А, или Q х. р = QТx А n А; (48)
x А n А, или Q х. р = QТx А n А; (48)
Q прод = n R С рмR(Т R – Т 0),
где QТ 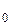 и QТ – тепловой эффект реакции при стандартной температуре и температуре в зоне реакции соответственно, кДж; n А, n R – химическое количество входящих реагентов и выходящих продуктов, моль или кмоль; Т 0 – температура начала отчсета энтальпии, 298 К; Т А и Т R – температуры реагентов и продуктов соответственно, К.
и QТ – тепловой эффект реакции при стандартной температуре и температуре в зоне реакции соответственно, кДж; n А, n R – химическое количество входящих реагентов и выходящих продуктов, моль или кмоль; Т 0 – температура начала отчсета энтальпии, 298 К; Т А и Т R – температуры реагентов и продуктов соответственно, К.
Если размерность теплоемкости выражена в Дж/(кг × К) или кДж/(кг × К), то в уравнение вместо n подставляется m, т. е. масса реагентов или продуктов.
Необходимо отметить, что при составлении тепловых балансов могут вноститься следующие упрощения.
1) Изменение Т мало отражается на величине Q. Это обусловлено возрастанием энтальпии всех реагентов с нагреванием. Допущение Q» const означает также малое влияние температуры на разность теплоемкостей исходной и прореагировавшей реакционных смесей.
2) Средние значения Q и С р (удельной теплоемкости) в рабочем температурном интервале остаются практически неизменными.
Следовательно, теплоемкость всей смеси – произведение mС р – также мало различается для входного и выходного потоков. Если пользоваться массовыми величинами потоков, то и удельные теплоемкости можно принять мало меняющимися в процессе. Например, в синтезе аммиака, в котором С р компонентов (Н2, N2, NH3) различаются в несколько раз и в процессе значительно изменяется их содержание, теплоемкость смеси на входе отличается от теплоемкости смеси на выходе менее чем на 10%.
Исходя из вышеизложенного, уравнение теплового баланса (40), с учетом принятых допущений, можно записать в следующем виде:
m исх С р исх(Т 1 – Т 0) + Qх. р = m прод С р прод(Т 2 – Т 0);
m исх С р исх Т 1 – m исх С р исх Т 0 + Q х. р = m прод С р прод Т 2 – m прод С р прод Т 0.
Слагаемое m исх С р исх с учетом допущения 2 практически равно m прод С р прод. Тогда после сокращения членов уравнения, содержащих Т 0, уравнение примет вид
m исх С р исх Т 1 + Q х. р = m прод С р прод Т 2. (49)
Это уравнение можно использовать для расчета теплового баланса.
В технической литературе по расчетам химико-технологических процессов часто температурой начала отсчета энтальпии является 0ºС. В этом случае количество теплоты, поступающее в систему или выходящее из нее, рассчитывается по формуле
Q исх(прод) = n А(R) С рм Т А(R). (50)
Для оценки погрешности расчета теплового баланса с учетом уравнений (40) и (50) ниже рассмотрен следующий пример.
Дата публикования: 2015-10-09; Прочитано: 779 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
