 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Пример 5. Рассчитать расход известняка, содержащего 12% примесей, для получения 1000 м3 (н
|
|
Рассчитать расход известняка, содержащего 12% примесей, для получения 1000 м3 (н. у.) СО2, если термообработанный продукт содержит 90,5% СаО и 5,5% СаСО3. Примеси в известняке – вода и SiO2. Составить материальный баланс процесса получения негашеной извести по реакции СаСО3 = СаО + СО2.
Решение.
Степень превращения СаСО3 в данном процессе ниже 100%, поэтому конечный продукт, как видно из условия, содержит часть исходного реагента. В 1 т продукта указанного состава содержится 905 кг СаО и 55 кг СаСО3. Масса разложившегося СаСО3, исходя из уравнения реакции, равна
 = 905 · 100 / 56 = 1 616 кг;
= 905 · 100 / 56 = 1 616 кг;
Следовательно для получения 1 т продукта необходимо
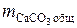 = 1 616 + 55 = 1 671 кг.
= 1 616 + 55 = 1 671 кг.
Тогда степень превращения составит
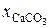 = (1 671 – 55) / 1 671 = 0,967, или 96,7%.
= (1 671 – 55) / 1 671 = 0,967, или 96,7%.
Расход СаСО3 на получение 1 000 м3 СО2 равен:
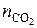 = 1000 / 22,4 = 44,64 кмоль СО2;
= 1000 / 22,4 = 44,64 кмоль СО2;
 = 44,64 · 100 = 4 464 кг.
= 44,64 · 100 = 4 464 кг.
С учетом степени превращения
 = 4 464 / 0,967 = 4 573 кг.
= 4 464 / 0,967 = 4 573 кг.
Масса известняка с учетом примесей равна
m изв = 4 464 / 0,88 = 5 197 кг.
Масса образующегося СаО
m СаО = 44,64 · 56 = 2 500 кг.
Общая масса технической извести
m техн. изв = 2 500 / 0,905 = 2 688,3 кг,
в том числе СаСО3
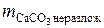 = 2 688,3 · 0,055 = 109 кг.
= 2 688,3 · 0,055 = 109 кг.
В состав извести также в качестве примеси входит SiO2, масса которого равна
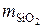 = 2 688,3 – 2 500 – 109 = 79,3 кг.
= 2 688,3 – 2 500 – 109 = 79,3 кг.
Масса образовавшегося СО2 составляет
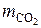 = 44,64 · 44 = 1 964,6 кг.
= 44,64 · 44 = 1 964,6 кг.
Тогда массу образующегося водяного пара можно определить как разницу между массой известняка и массами технической извести и СО2:
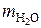 = 5 197 – 2 688,3 – 1 964,6 = 544,1 кг.
= 5 197 – 2 688,3 – 1 964,6 = 544,1 кг.
Результаты расчета сведены в табл. 8.
Таблица 8
Дата публикования: 2015-10-09; Прочитано: 876 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
