 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Вивчення нового матеріалу. Елекролітична дисоціація
|
|
Елекролітична дисоціація. З курсу хімії та курсу фізики 9 класу вам відомо, що всі речовини поділяються на електроліти і неелектроліти. Електроліти характеризуються тим, що їх розчини або розплави є провідниками електричного струму. Розчини або розплави неелектролітів не проводять електричного струму.
Багато речовин уже в твердому стані мають йонну структуру (хлористий натрій та деякі солі). Але в твердому стані йони міцно зв’язані один з одним, оскільки мають протилежні електричні заряди, з за цього їх рухливість ускладнена. У розплаві рухливість йонів збільшується і особливо збільшується при переході речовини у розчин. У розчині під впливом полярних молекул води речовина – електроліт розпадається на позитивно заряджені та негативно заряджені йони. Якщо в такому розчині створити електричне поле, то позитивно заряджені йони рухатимуться до катода (негативно заряджений електрод), а негативно заряджені йони - до анода (позитивно заряджений електрод). Відповідно, позитивно заряджені йони назвали катіонами, а негативно заряджені йони – аніонами. Розпад деяких речовин на йони під дією полярних молекул води назвали електролітичною дисоціацією. Малюнок іллюструє процес електролітичної дисоціації в розчині кухонної солі. Необхідно відмітити, що при зустрічі двох різнополярних іонів хлору і натрію можливий обернений процес – рекомбінації (утворення нейтральної молекули NaCl). Обидва процеси в розчині відбуваються одночасно.
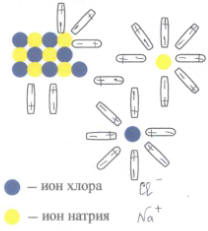
Мал. Процес електролітичної дисоціації
Шведський хімік Саванте Арреніус провів дослідження залежності електропровідності електролітів від їх концентрації. На підставі цих досліджень Арреніус запропонував теорію електролітичної дисоціації (іонізації), яка зараз є загальною науковою теорією. Суть цієї теорії полягаю у наступному:
При розчиненні у воді електроліти дисоціюють (розпадаються) на позитивні і негативні частинки (іони).
Під дією електричного струму позитивні іони переносяться до катода, а негативні іони – до анода.
Не всі електроліти однаковою мірою розпадаються на іони. Повнота розпаду залежить від природи електроліту, його концентрації, характеру розчинника, температури. Процес електролітичної дисоціації є оборотним
процесом. Тому при написанні реакцій дисоціації ставлять знак зворотності (↔). Наприклад, процес електролітичної дисоціації сірчаної кислоти записується з урахуванням оборотного процесу наступним чином
H2SO4↔2H+ + SO42-.
Електроліти поділяються на сильні і слабкі. Сильні електроліти у водних розчинах практично цілком дисоціюють на іони, а слабкі – тільки частково.
Електроліз. Якщо в розчині електроліту створити постійне за напрямом електричне поле то катіони почнуть рухатись до катода, а аніони – до анода (мал.)
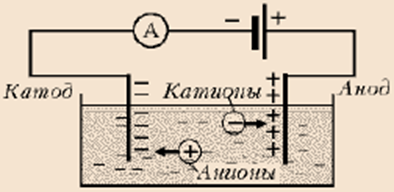
Мал. Рух електрично заряджених частинок в розчині електроліту
Катіони стикаючись з катодом, приймають від нього недостаючі електрони, тобто відновлюються. Наприклад: Cu2+ + 2e →Cu.
На аноді відбувається процес віддачі електронів аніона аноду, тобто відбувається процес окислення: 2Cl-→Cl2+2e. (Окислювач — речовина, до складу якої входять атоми, що приєднують під час хімічної реакції електрони, іншими словами, окислювач — це акцептор електронів. Акцептор (лат. accipio — «приймати, отримува-ти») — це об'єкт, що приймає що-небудь від іншого об'єкту, званого донором.)
Процеси, що відбуваються при проходженні електричного струму через розчини електролітів, називають електролізом. При електролізі катод є відновником, оскільки він віддає електрони катіонам, а анод – окислювачем, оскільки він приймає електрони від аніонів.
Ці процеси відбуваються під дією електричного струму, тому вони називаються процесами або реакціями електровідновлення і електроокислення.
Вольт-амперна характеристика електролітів. Вольт-амперна характеристика проходження електричного струму в електроліті має лінійний характер як і в металів, але відрізняється тим, що для створення електричного струму в електроліті, необхідна певна робота зовнішнього електричного поля для подолання внутрішнього поля, деполяризації електроліту (напруга цього поля для різних електролітів має різне значення) (мал.).
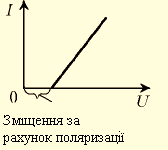
Мал. Вольт-амперна характеристика проходження електричного струму в електроліті
Залежність опору електроліту від температури. Графік залежності опору електроліту від температури (мал.) має нелінійну характеристику. Це пояснюється тим, що з ростом температури тепловий рух молекул стає більш інтенсивним, з за цього число іонів у розчині та їх концентрація зростають.
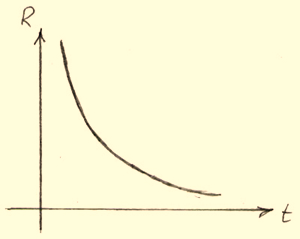
Мал. Графік залежності опору електроліту від температури
При цьому з підвищенням температури змінюється питомий опір електроліта (ρ). Його зміну можна розрахувати за рівнянням, яке використовували у аналогічних розрахунках для металів ρ = ρ0 (1+α∙t). ρ0 – питомий опоір електроліту при 00 С; α – термічний коефіцієнт опору. Для електролітів завжди термічний коефіцієнт опору є від’ємним (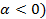 .
.
Закони електролізу. З курсу фізики 9 класу вам відомо, що вивчаючи проходження електричного струму через електроліти англійський фізик Майкл Фарадей експериментально встановив, що маса m речовини, яка виділяється на електроді під час електролізу, пропорційна силі струму І та часу t його проходження через електроліт:
m = k∙I∙t,
де k- електрохімічний еквівалент речовини.
Електрохімічний еквівалент речовини чисельно дорівнює масі речовини, яка виділяється на електроді за 1с під час проходження через електроліт струму силою 1а  .
.

| Майкл Фарадей (1791-1867) — англійський фізик, основоположник вчення про електромагнітне поле. Виявив хімічну дію електричного струму, взаємозв'язок між електрикою і магнетизмом, магнетизмом і світлом. Відкрив (1831) електромагнітну індукцію — явище, яке лягло в основу електротехніки. Встановив (1833-34) закони електролізу, названі його ім'ям, відкрив пара- і діамагнетизм, обертання плоскості поляризації світла в магнітному полі (ефект Фарадея). Довів тотожність різних видів електрики. Фарадей ввів поняття електричного і магнітного поля, висловив ідею існування електромагнітних хвиль. Вчився у хіміка і фізика, одного із засновників електрохімії Гемфрі Деві. |
Цей закон названо першим законом Фарадея.
Другий закон Фарадея встановлює залежність між хімічними еквівалентами та їх електрохімічними еквівалентами. Нагадаємо, що хімічними еквівалентами називають відношення атомних мас речовин M до їх валентностей Z - 
Електрохімічний еквівалент речовини пропорційний його хімічному еквівалененту:
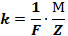
F – коефіцієнт пропорційності, який називають сталою Фарадея.
Фізичний зміст законів Фарадея легко зрозуміти використавши електронно – іонну теорію.
Маса речовини, що виділяється на електродах при електролізі визначається масою йонів N, що осідають на електроді. Кількість йонів дорівнює 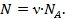 𝝂 –кількість речовини що виділилась на електроді в процесі електролізу, 𝝂 =
𝝂 –кількість речовини що виділилась на електроді в процесі електролізу, 𝝂 = 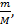 m – маса речовини, М – її молярна маса, NA – число Авогадро. Але з іншої сторони число йонів, що осіли, можна визначити через величину заряду Q=I∙t, що пройшов через електроліт і заряд одного йона q0:
m – маса речовини, М – її молярна маса, NA – число Авогадро. Але з іншої сторони число йонів, що осіли, можна визначити через величину заряду Q=I∙t, що пройшов через електроліт і заряд одного йона q0: 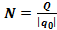 . Отже,
. Отже, 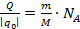 . Звідки
. Звідки 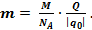 Заряд будь якого йона дорівнює заряду одновалентного йона, тобто заряду електрона е, помноженому на валентність Z йона:
Заряд будь якого йона дорівнює заряду одновалентного йона, тобто заряду електрона е, помноженому на валентність Z йона: 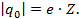
Таким чином, 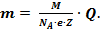 Величини NA і е є універсальними сталими, а M і Z сталі для даної речовини. Тому вираз
Величини NA і е є універсальними сталими, а M і Z сталі для даної речовини. Тому вираз 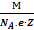 = k – електрохімічному еквіваленту речовини. Добуток NA∙e = F (число Фарадея), універсальна стала і визначає заряд, який необхідно пропустити крізь розчин електроліту, щоб на електроді виділилась маса речовини чисельно рівну хімічному еквіваленту. F≈ 96 500Кл/моль.
= k – електрохімічному еквіваленту речовини. Добуток NA∙e = F (число Фарадея), універсальна стала і визначає заряд, який необхідно пропустити крізь розчин електроліту, щоб на електроді виділилась маса речовини чисельно рівну хімічному еквіваленту. F≈ 96 500Кл/моль.
Використання електролізу. Явище електролізу знаходить різні використання у сучасній техніці. Розглянемо деякі з них.
Гальваностегія. (від гальвано... і греч. stego - покриваю) – нанесення металлічеських покриттів на поверхню металевих і інших виробів методом електролітичного осадження. Розділ гальванотехніки. Деталі технічних пристроїв, деякі частини предметів побуту інколи покривають тонкою плівкою благородного металу (платина, золото, срібло). Це робиться в декоративно-естетичних цілях і з метою оберігання відповідних частин конструкцій від корозії. У техніці для запобігання корозії окремі деталі різних пристроїв покривають нікелем, хромом, кадмієм. В наш час такі покриття, як правило, наносять гальванічним способом. Деталь заздалегідь ретельно очищають і поміщають в електролітичну ванну, наповнену водним розчином солі відповідного металу, і сполучають з негативним полюсом джерела струму. Анодом служить пластинка з того ж металу. В результаті електролізу на поверхні деталі осідає шар речовини, сіль якої знаходиться в розчині електроліту (мал.).
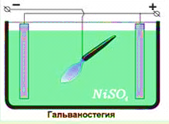
Мал. Гальваностегія
Електролітичне рафінування є електролізом водних розчинів або солевих розплавів, дозволяє отримувати метали високої чистоти. Застосовується для глибокого очищення більшості кольорових металів. Рафінування міді. Металургійна мідь, тобто мідь, отримана з руди в правильній печі, містить, як правило, всілякі домішки. Для очищення (рафінування) міді від домішок інших речовин масивні листи металургійної міді опускають в розчин сульфату міді і сполучають з позитивним полюсом джерела струму. Як катод беруть тонкі листи чистої міді. При проходженні електричного струму через електроліт чиста мідь виділяється на катоді, а анод поступово розчиняється. Домішки випадають в осад. Концентрація мідного купоросу залишається постійною (мал.). Електроліз використовується для здобуття ряду інших кольорових металів. Енергія, що витрачається на це, обчислюється мільярдами кіловат годин на рік.

Мал. Електролітичне рафінування
Електролітична поліровка. Кількості речовини, що осідає на електроді або перехідного з електроду в розчин, пропорційно силі струму. Але на випуклих ділянках, як ми знаємо, напруженість поля більша, ніж на плоских ділянках поверхні. Отже, в цих місцях щільність струму більша, ніж на плоских ділянках. Тому, якщо виріб з шорсткою поверхнею занурити як анод в електричну ванну з відповідним чином підібраним електролітом, то метал з виступом буде переходити в розчин з більшою швидкістю, ніж із западин, і шорсткості згладжуватимуться (мал.). На цьому принципі грунтується електрополірування металів, а також електрозаточування інструментів.
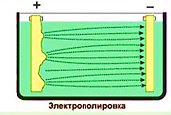
Мал. Електролітична поліровка.
Електрометалургія. Явище електролізу використовується для отримання алюмінію, натрію, магнію, берилію і інших металів з відповідних розплавлених руд. Між дном ванни і вугільними електродами запалюють електричну дугу, в якій температура перевершує 25000С. У полум'ї дуги руда плавиться, і відбувається електролітична дисоціація молекул. Через дисоційований розплав, що утворюється, пропускають електричний струм, внаслідок чого на дні ванни осідають молекули металу. Розплавлений метал стікає по похилому дну ванни в спеціальні ковші.
Гальванопластика. Використовуючи явище електролізу, можна отримувати абсолютно точні рельєфні копії предметів (наприклад, монет, медалей, ювелірних прикрас і так далі). Для цього з предмету спочатку роблять зліпок з якого-небудь пластичного матеріалу (наприклад, з воску). Потім поверхню цього зліпка роблять електропровідною, покриваючи її тонким шаром електропровідної речовини. Підготовлений таким чином зліпок поміщають в електролітичну ванну як катод. Пропускаючи через ванну електричний струм, покривають зліпок товстим шаром металу. За допомогою гальванопластики виготовляються, наприклад, точні копії дорогоцінних прикрас, знайдених при археологічних розкопках, штампи для виробництва грамплатівок та ін.
Електричний струм в газах. З курсу фізики 9 класу вам відомо, що: в природному стані гази є діелектриками. Тому, що в звичайних умовах в газі майже немає вільних носіїв заряду, рух яких міг би створити електричний струм. Про це свідчить дослід (мал.).

Мал. Демонстрація відсутності носії струму в газах
Якщо розташувати дві металеві пластини паралельно одна одній, з'єднати одну з стержнем, а другу з корпусом електрометра і зарядити їх різнойменними зарядами,то, спостерігаючи за показами електрометра, можна констатувати, що він не розряджається. Значить, при невеликих значеннях напруги через повітря між пластинами електричний струм не проходить. Ізоляційні властивості газів (повітря) пояснюються відсутністю в них вільних електричних зарядів: атоми і молекули газів в природному стані є нейтральними. Для того, щоб газ став провідником струму необхідно створити в ньому вільні носії заряду, тобто, перетворити нейтральні молекули (чи атоми) газу на йони.

Мал. Нагріте повітря проводить електричний струм
Видозмінимо дослід. Нагріватимемо повітря між дисками полум'ям спиртівки (мал.). Кут відхилення стрілки електрометра швидко зменшується, тобто зменшується різниця потенціалів між дисками конденсатора - конденсатор розряджається. Висновок: нагріте повітря між дисками стало провідником електричного струму.
Дата публикования: 2015-09-17; Прочитано: 3340 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
