 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Фазы. Фазовые диаграммы. Тройная точка
|
|
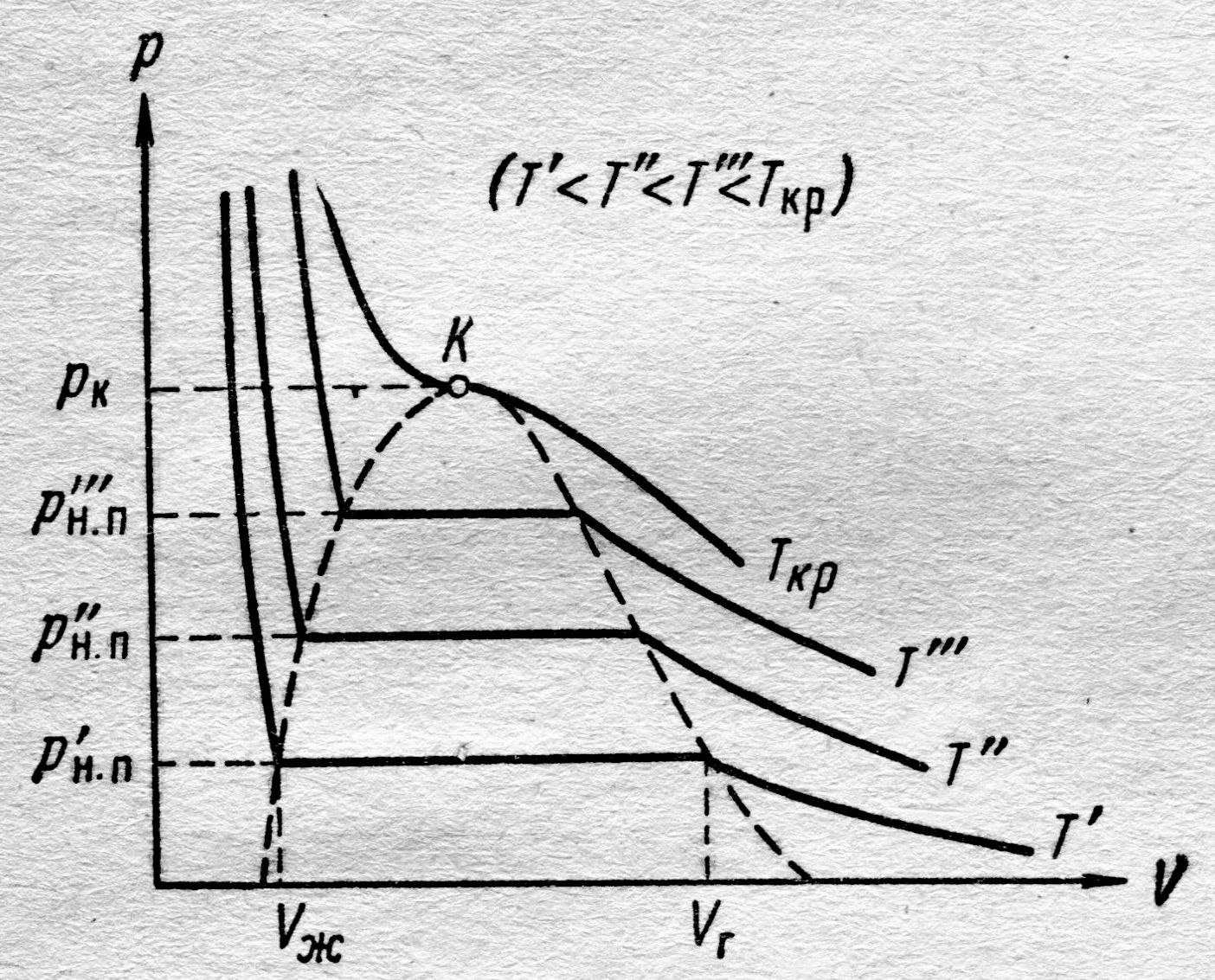
| Рис. 8.5. Экспериментальные изотермы реального газа для четырёх значений температуры |
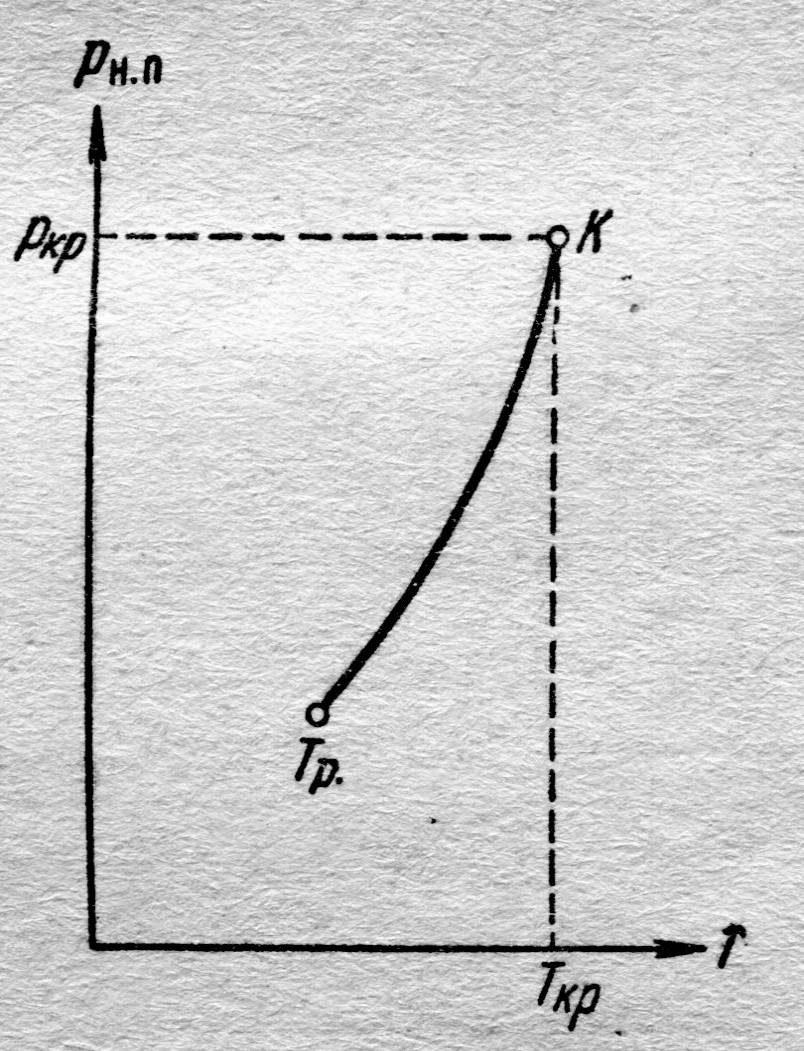
| Рис. 8.6. Диаграмма равновесия двухфазной системы насыщенный пар–жидкость |
На диаграмме давление насыщенного пара р н.п(Т) изменяется нелинейно (рис. 8.6.), по кривой. Это обусловлено тем, что с повышением температуры различие в энергиях молекул жидкости и пара уменьшается, уменьшается и теплота испарения по формуле, установленной экспериментально: 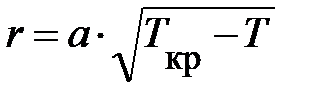 , где а – коэффициент, свой для разных жидкостей.
, где а – коэффициент, свой для разных жидкостей.
Начинается кривая р н.п(Т) в точке, которую принято называть тройной точкой (Тр .) (рис. 8.6). Почему? Для уяснения смысла возьмём вещество в виде жидкости и находящегося с ней в равновесии насыщенного пара и, не изменяя объёма, будем понижать температуру системы. Понижение температуры вещества сопровождается уменьшением давления р н.п. Поэтому точка, отображающая состояние вещества на диаграмме (р, Т), будет перемещаться вниз по кривой испарения К ® Тр. (рис. 8.7). Это продолжается до тех пор, пока не будет достигнута температура кристаллизации вещества, отвечающая равновесному значению давления. Эту температуру принято обозначают символом Т тр. (рис. 8.7). Пока идёт процесс кристаллизации, температура и давление остаются неизменными. Отбираемое от системы тепло, представляет собой тепло, выделяющееся при кристаллизации.
Температура Т тр. и соответствующее ей равновесное давление р тр. – единственные значения температуры и давления, при которых могут находиться в равновесии три фазы вещества: твёрдая, жидкая и газообразная. Соответствующая точка на диаграмме, рис. 8.7, Тр. с параметрами (р тр, Т тр) и называется тройной точкой; т. е. тройная точка определяет условия, при которых могут находиться в равновесии три фазы вещества.

| Рис. 8.7. Диаграмма равновесного состояния вещества |
Температура тройной точки является той температурой, при которой плавится вещество, находясь под давлением, равным р тр. При других давлениях температура плавления будет иной. Связь между давлением и температурой плавления отобразится на диаграмме (р, Т) кривой плавления, начинающейся в тройной точке (рис. 8.7). Таким образом, тройная точка – результат пересечения трёх кривых, определяющих условия равновесия двух фаз: твёрдой-жидкой, жидкой-газообразной и твёрдой-газообразной.
На диаграмме (рис. 8.7) кривые плавления, испарения и сублимации разбивают координатную плоскость на три области, в которых находятся, соответственно, твёрдая, жидкая и газообразная фаза. Любая точка, лежащая на одной из разграничивающих области кривых, отображает состояние равновесия двух соответствующих фаз вещества. Тройная точка отображает состояние равновесия всех трёх фаз. Поскольку каждая точка на диаграмме отображает определённое состояние вещества, её называют диаграммой состояния. Диаграмма состояния может предсказать, какие превращения будет претерпевать вещество при различных процессах.
Если взять вещество, находящееся в состоянии 1 (рис. 8.7), и подвергнуть его изобарическому нагреванию, то по пунктирной линии оно из кристаллического состояния через жидкую фазу переходит в газообразное состояние 2. Если пытливый читатель возьмёт это же вещество, но в состоянии 3 (рис. 8.7.), и подвергнет его изобарическому нагреванию, то через какие фазовые состояния пройдёт вещество, оказавшись в точке 4? Какое это может быть вещество?
В заключение параграфа следует заметить, фазовые переходы, сопровождающиеся изменением внутренней энергии вещества и связанных с ней величин, принято называть фазовыми переходами первого рода.
Переходы, не связанные с поглощением или выделением тепла, но сопровождающиеся изменением его внутренней структуры, называются фазовыми переходами второго рода.
Дата публикования: 2015-09-17; Прочитано: 828 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
