 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Элементы теории. Рассмотрим фазовую диаграмму однокомпонентной системы (то есть чистого вещества) с координатами: давление (Р) и температура (Т) - рис
|
|
Рассмотрим фазовую диаграмму однокомпонентной системы (то есть чистого вещества) с координатами: давление (Р) и температура (Т) - рис. 3.1 для CO2, рис. 3.2 для H2O.
|
 осуществуют все три агрегатных состояния).
осуществуют все три агрегатных состояния).
|
 Рис. 3.1 Рис. 3.2
Рис. 3.1 Рис. 3.2
Условие равновесия между двумя фазами однокомпонентной системы описывается уравнением Клапейрона:
dP/dT = ΔH/TΔV, (3.1)
где dP/dT – наклон кривой равновесия двух фаз при температуре Т, ΔH и ΔV - изменение мольной энтальпии и мольного объема вещества при любом фазовом переходе (испарение, сублимация, плавление, полиморфное превращение и др.).
При плавлении мольный объем изменяется незначительно, так как плотности вещества в твердом и жидком состоянии близки. Поэтому величина ΔV мала, и, согласно уравнению (3.1), производная dP/dT велика. Поэтому линия плавления (граница между твердым и жидким агрегатными состояниями) имеет очень крутой наклон. Для воды наклон этой линии отрицательный, так как плотность твердого льда меньше, чем жидкой воды (аномальное свойство воды). Для остальных веществ наклон линии плавления положителен.
Для фазовых переходов испарения и возгонки величина ΔV велика. Например, для воды при 0 °C Vпар = 22,4 л и Vж = 0,018 л. Клаузиус показал, как можно упростить уравнение (3.1) в случае испарения или возгонки, если пренебречь мольным объемом жидкости или твердого тела, по сравнению с мольным объемом пара и если считать пар идеальным газом. Используем уравнение состояния идеального газа для 1 моля вещества: подставляем RT/P вместо Vпар. В результате получаем:
dP/dT = ΔHисп/TVпар =PΔHисп/RT2 (3.2)
После преобразования это уравнение переходит в уравнение Клаузиуса-Клапейрона:
dlnP/dT = ΔHисп/RT2 (3.3)
Аналогичное уравнение справедливо для сублимации.
С помощью уравнения (3.3) можно рассчитать мольную энтальпию испарения жидкости. Для такого расчета удобно применять уравнение Клаузиуса-Клапейрона в интегральной форме. Если разделить переменные и сделать допущение о постоянстве мольной энтальпии испарения в исследованном интервале температур, то можно интегрировать уравнение:
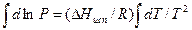 (3.4)
(3.4)
Для определения постоянной интегрирования необходимо задать граничные условия, т.е. значения давления Р1 и Р2 при двух температурах Т1 и Т2. Получаем:
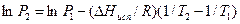 (3.5)
(3.5)
Если считать P2 и Т2 переменными и обозначить их через Р и Т, то полученное из уравнения (3.5) выражение является уравнением прямой линии в координатах lnP ─ 1/T. Тангенс угла наклона этой прямой к оси абсцисс равен ΔHисп/R.
Содержание части 1 домашнего задания №3
- Построение графика 1 зависимости давления насыщенного пара заданного вещества от температуры по данным табл.1 тетради для домашних заданий.
- Построение графика 2 зависимости логарифма давления насыщенного пара заданного вещества от обратной абсолютной температуры.
- Определение с помощью этих графиков мольной теплоты испарения заданного вещества.
- Определение с помощью этих графиков температуры кипения заданного вещества при заданном давлении.
Оформление расчета (часть 1)
А) Определить мольную теплоту испарения данного вещества по графику 2.
Используя данные табл.1, построить график 2 зависимости натурального логарифма давления от обратной абсолютной температуры. Давление можно выражать в относительных единицах.
По тангенсу угла наклона прямой находится величина: ΔНисп = R·tgα. Тангенс угла наклона определяется как отношение отрезков (катетов выделенного прямоугольного треугольника), измеренных в соответствующих единицах (безразмерных логарифмов и обратных кельвинах).
Б) Определить температуру кипения данного вещества при заданном давлении.
Для определения температуры кипения данного вещества при заданном давлении можно воспользоваться графиком 1. Температуру кипения (Тк) вещества при заданном давлении можно определить, если провести горизонтальную прямую от заданного давления до пересечения с графиком и из точки пересечения опустить перпендикуляр на ось абсцисс.
Часть 2. Двухкомпонентные системы. Определение состава жидкопаровой смеси, температур начала и конца кипения жидкой смеси данного состава.
Содержание части 2домашнего задания №3
Дата публикования: 2015-09-17; Прочитано: 536 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
