 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Элементы теории. Химические реакции, протекающие в одну стадию, называются простыми
|
|
Химические реакции, протекающие в одну стадию, называются простыми. Такие реакции различают по молекулярности
Молекулярность реакции определяется числом частиц, принимающих участие в элементарном акте химического взаимодействия.
Молекулярность может быть равна 1, 2 или 3, соответственно, различают моно- би- и тримолекулярные реакции. Для простых реакций молекулярность совпадает с порядком реакции, а порядки по компонентам совпадают с наименьшими целочисленными стехиометрическими коэффициентами в левой части химического уравнения. Фактически, если известна молекулярность реакции, то понятен и ее истинный механизм, для установления которого проводят серьезные исследования.
Рассмотрим кинетику простых реакций 1, 2 и 3-го порядков.
Реакции первого порядка: A ® L+ M
Порядок реакции (n) равен 1. Пусть концентрация вещества А (СА) равна С, тогда скорость реакции (w=-dС/dt) в соответствии с законом действующих масс равна
-dС/dt = kС.
Латинская буква d здесь и далее обозначает знак дифференциала, то есть бесконечно малого изменения величины. Разделим переменные: -dС/С=kdt, проинтегрируем:-lnС = kt + const, определим константу интегрирования, учитывая, что в начальный момент времени: t = 0, С = С0, отсюда const = -lnС0. В итоге получаем: lnС – lnС0 =- kt,
ln(С/С0) = - kt, С = С0 e-kt. (1.1, 1.2)
Уравнения (1.1) и (1.2) называются кинетическими уравнениями реакции первого порядка в логарифмической (1.1) и экспоненциальной (1.2) форме.
Важной кинетической характеристикой процесса является время полупревращения (t1/2), то есть время, в течение которого прореагировала половина взятого вещества.
Определим эту величину для реакции первого порядка: С = 1/2С0, ln(С0/С) = ln2/kt1/2,
t1/2 = ln2/k = 0,69/k. (1.3)
Время полупревращения в этом случае не зависит от начальной концентрации исходного вещества.
Размерность константы скорости для реакций первого порядка: [k] = [с]-1.
Реакции второго порядка: А + В ® L.
Порядок реакции равен 2. Пусть СA = СB = С. Тогда -dС/dt = kС2, -dС/С2 = kdt. После интегрирования и с учетом начальных условий (t = 0, С = С0) получаем:
1/С – 1/С0= kt. (1.4)
Время полупревращения для реакций второго порядка обратно пропорционально начальной концентрации:
t1/2 = 1/(kС0). (1.5)
Размерность константы скорости: [k] = [л/(моль с)].
Реакции третьего порядка: А + В + D® L.
Величина n равна 3. Пусть СA = СB = СD = С, тогда -dС/dt = kС3, -dС/С3 = kdt. После интегрирования, учитывая начальные условия (t = 0, С = С0), получаем:
1/С2 – 1/С02= 2kt. (1.6)
Время полупревращения для реакций третьего порядка обратно пропорционально квадрату начальной концентрации:
t1/2 = 3/(2kС02). (1.7)
Размерность константы скорости: [k] = [л2/(моль2 с)].
В представленных кинетических уравнениях под символом «С» понимают текущую, то есть наблюдаемую в данный момент времени молярную концентрацию соответствующих исходных веществ (С = Cт.). Существует также понятие прореагировавшей концентрации (Cпр), характеризующее ту часть концентрации данного исходного вещества, которая превратилась в конечный продукт. Прореагировавшая концентрация связана с текущей и исходной (C0) соотношением:
С0 = Cт + Cпр (1.8).
В расчетах по уравнениям (1.1-1.7) нужно знать величину константы скорости реакции (k). Эту характеристику можно найти с помощью уравнения Аррениуса, если известны предэкспоненциальный множитель (k0), энергия активации (Е) и температура (Т):
k = k0e-E/RT (1.9)
Значение константы скорости можно также определить графическим способом. Так, уравнения (1.1), (1.4) и (1.6) представляют собой прямолинейную зависимость соответствующих функций концентраций от времени: при n = 1 линейно от времени зависит lnC, при n = 2 – 1/С, при n = 3 – 1/С2 (рис. 1, 2, 3). На этой закономерности основан графический метод определения порядка реакции, позволяющий также определить и значение k.
Пусть n = 1 или 2. Тангенс угла наклона (α) соответствующей прямой к оси Х (ось времени) равен константе скорости (рис 1.1, 1.2) - tgα = k. При n = 3 удвоенная константа скорости равна тангенсу угла (α) наклона прямой (рис. 1.3) - 2 tgα = k. Не представляет затруднений нахождение времени полупревращения из этих графиков.
|
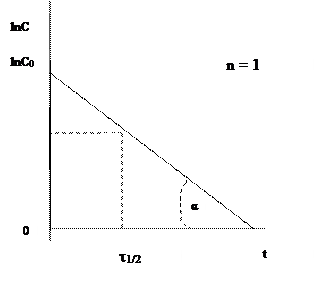
Рис. 1.1
|
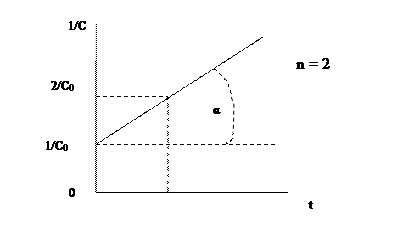
Рис. 1.2
|
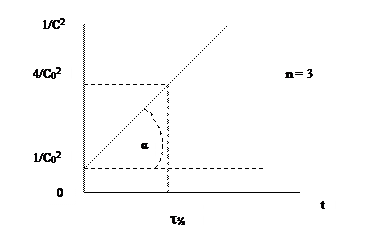
Рис. 1.3
В присутствии катализатора скорость химической реакции возрастает, что связано с изменением механизма реакции, приводящего к снижению энергии активации процесса. При катализе катализатор и реагирующее вещество образуют промежуточное соединение, которое в результате дальнейших преобразований превращается в конечный продукт, высвобождая катализатор. Энергетические затраты таких процессов ниже, чем в отсутствии катализатора. Каталитические реакции являются сложными, так как протекают в несколько стадий. Скорость процесса определяется скоростью самой медленной стадии катализа.
Величиной, определяющей ускорение реакции в при катализе, является соотношение констант скоростей реакций в присутствии (kк) и отсутствии (k) катализатора: kк/ k. Это значение можно рассчитать, если известна величина снижения энергии активации ∆Е. В расчетах будем полагать, что рассматриваемая реакция является односторонней, то есть необратимо протекает слева направо в соответствии с уравнением реакции.
Пусть ЕК = (Е - DЕ) – энергия активации прямой реакции в присутствии катализатора, Е – то же, но без катализатора. Тогда константа скорости прямой реакции в присутствии катализатора - kK = k0 exp[-(E - DE)/RT], без катализатора - k1 = k0 exp(-E/RT).
Ускорение при катализе равно:
kK/ k = exp (DE)/RT). (1.10)
Содержание домашнего задания №1
- Расчёт константы скорости (k1) заданной реакции при температуре (Т1).
- Построение графика 1 зависимости концентрации первого исходного вещества от времени: Сi = f(ti).
- Определение времени полупревращения аналитическим (t1/2ан) и графическими (t1/2гр) методами.
- Расчёт процента превращения (pI) и массы первого исходного вещества (m1) за определённое время (t1). Определение масс остальных участников реакции к этому моменту времени.
- Определение температуры (Т2), при которой за данное время ((t1) прореагирует заданная часть первого исходного вещества (p2).
- Построение кинетического графика 2 в "спрямляющих" координатах. Определение по этому графику константы скорости реакции (k1гр) и времени полупревращения (t1/2гр).
- Расчёт ускорения реакции при использовании катализатора (k1K/ k1).
Оформление расчета
Полагаем, что заданная реакция является простой (1-6 пункт задания) и односторонней (1-7 пункт задания).
1. Для нахождения константы скорости реакции (k1) нужно использовать заданное значение температуры (Т1), предэкспоненциального множителя (k0), и энергии активации (Е). Расчет выполняется по уравнению Аррениуса (1.9). Следует указать размерность величины k1 с учетом фактического (заданного) порядка реакции.
2. Для построения графика 1 зависимости текущей концентрации (С) первого исходного вещества от времени (t) необходимо составить таблицу 1.1.
В таблицу вносят рассчитанные промежуточные значений Сi, используя заданное значение начальной концентрации С0.
Далее, выбрав соответствующее заданному порядку кинетическое уравнение (1.1, 1.4, 1.6), для каждого из значений Сi нужно рассчитать значения текущего момента времени (ti) и занести их в таблицу 1.1. По данным этой таблицы (значения колонок 1 и 2) строят график 1: С = f(t).
При построении графика 1 (и далее графика 2) нужно помнить, что все расчетные точки соответствуют теоретическим моделям, поэтому при соединении точек должны быть образованы идеально построенные графические зависимости без выступов и изломов.
Таблица 1.1
| Сi (моль/л) | ti (с) | Линейная функция концентрации - |
| С0 = | t0=0 | |
| С1 =0,9 С0 = | t1 = | |
| С2 =0,8 С0 = | t2 = | |
| С3 =0,7 С0 = | t3= | |
| С4 =0,6 С0 = | t4= | |
| С5 =0,5 С0 = | t5= | |
| С6 =0,4 С0 = | t6= | |
| С7 =0,3 С0 = | t7= | |
| С8 =0,2 С0 = | t8= | |
| С9 =0,1 С0 = | t9= |
3. Для того, чтобы определить аналитическое значение времени полупревращения (t1/2ан.), нужно использовать в расчете одну из формул (1.3), (1.5). (1.7), выбрав ее, в зависимости от заданного порядка реакции.
Графическое значение t1/2гр можно найти по графику 1, как время, за которое концентрации уменьшается в два раза.
Следует рассчитать относительную ошибку (e) при нахождении времени полупревращения:
e (%) = ± [(t1/2ан – t1/2гр)/ t1/2ан] · 100 (%). (1.11)
4. Процент превращения первого исходного вещества (p1) можно определить по формуле:
p1 = (C1пр/ С0)· 100 (%). (1.12)
Используя заданное значение времени t1, можно найти с помощью соответствующего кинетического уравнения (1.3, 1.5. 1.6) значение текущей концентрации C1т; далее по формуле (1.8) нужно определить прореагировавшую концентрацию C1пр, затем по формуле (1.12) вычислить искомую величину p1.
Массу первого вещества (mI, г), прореагировавшего за время t1, можно определить, используя формулу, позволяющую рассчитать соответствующую молярную концентрацию
С1пр = mI /MI·V (1.13),
где MI –молярная масса этого вещества, г/моль, V – заданный объем, л. Полученную величину mI следует перевести в килограммы.
Нужно также определить массы остальных участников реакции, прореагировавших к моменту времени t1. Расчет делают по заданному уравнению химической реакции относительно найденной величины mI с учетом стехиометрических коэффициентов и молярных масс веществ. Например, для реакции aA +bB =lL + nN,
где mA= mI, МА=МI – молярная масса первого вещества
mB = (mI· b·MB)/(a·MI). (1.14)
Аналогичным образом можно найти массы остальных продуктов реакции - mL, mN.
Следует проверить выполняемость закона сохранения масс:
mA + mB ≡ mL,+ mN. (1.15)
5. Заданное значение степени превращения первого вещества p2 отличается от найденной ранее величины p1, так как полагается, за одно и то же время t1 процентное количество прореагировавшего вещества различно, из чего следует, что реакции протекают при разных температурах Т1 и Т2 и, следовательно, имеют разные константы скорости - k1 при температуре Т1 и k2 при температуре Т2.
Для определения температуры Т2 сначала надо найти новое значение прореагировавшей концентрации первого исходного вещества С2пр, используя формулу (1.12). Затем следует найти новое значение текущей концентрации С2т с помощью формулы (1.8).
С найденным значением С2т можно рассчитать константу скорости реакции (k2) при температуре Т2 по кинетическому уравнению реакции заданного порядка (одна из формул 1.1, 1.4, 1.6).
Определив k2, по уравнению Аррениуса (1.9), нужно рассчитать температуру Т2 (К). Для этого надо прологарифмировать уравнение (1.9) и выразить Т2:
T2 = E/[Rln(k0/k2] (1.16)
6. В зависимости от заданного порядка реакции следует выбрать функцию концентрации, линейно зависящую от времени, рассчитать соответствующие значения и внести их в третью колонку таблицы 1.1.
Значения функции, определяют, используя величины Сi первого столбца этой таблицы. По данным второй и третьей колонок данной таблицы строят график 2.
Масштаб по оси X (ось времени, t) графика 2 можно выбрать таким же, как на графике 1, а масштаб на оси Y желательно подобрать так, чтобы наклон прямой линии был близок к 450. Это обеспечивает наибольшую точность определения константы скорости реакции по угловому коэффициенту графика 2. Для этого необходимо выделить прямоугольный треугольник и найти отношение величин вертикального и горизонтального катетов (не в единицах длины, а в единицах тех величин, которые они выражают). Полученную величину k1гр надо сравнить с рассчитанной k1 в первом задании и найти относительную ошибку:
e (%) = ± [(k1 – k1гр)/ k1] · 100 (%). (1.17)
По графику 2 необходимо также найти время полупревращения первого вещества, t1/2гр. Для этого на оси Y следует отложить величину, соответствующую функции половинной концентрации.
Для первого порядка это будет значение ln(C0/2)=lnC0-ln2, то есть от значения lnC0 надо отложить вниз отрезок, равный ln2, через полученную точку провести горизонтальную прямую, до пересечения с графиком, и из точки пересечения опустить перпендикуляр на ось Х.
Для реакции второго порядка надо представить на оси Y величину 2/C0, что можно сделать, прибавив к отрезку, выражающему 1/C0, отрезок такой же длины, из полученной точки провести горизонтальную прямую и т.д.
Для реакции третьего порядка надо представить на оси Y величину (2/C0)2=4/C02, что можно сделать, прибавив к отрезку, выражающему 1/C02, отрезок утроенной длины.
7. Увеличение скорости реакции в присутствии катализатора следует определить по формуле (1.10).
Абсолютное значение снижения энергии активации (DE, Дж/моль) можно найти, зная величину снижения энергии активации в процентах (h,%):
DE = (h/100)·Е (1.18).
Таблица исходных данных
| Реак- ция | Порядок реакции, n | Т1, К | k0, (л/моль)n – 1с-1 | E, Дж/моль | C, моль/л | t1, c | V, л | p2, % | h |
Таблица конечных данных
| Константа скорости, k1, (л/моль)n – 1 (с)-1 | Время полупревра-щения t1/2, с | Расход первого вещества к моменту t1 | Т2, К | Ускоре-ние при катализe k1K/ k1 | ||
| t1/2гр | t1/2ан | p1, % | mI, кг | |||
Вопросы для самоконтроля
1. Что такое порядок реакции, какие значения он может принимать?
2. Можно ли по уравнению химической реакции, по виду графика 1 определить порядок реакции? Ответ пояснить.
3. Что такое молекулярность реакции? Когда порядок и молекулярность реакции совпадают?
4. Дать определение времени полупревращения и пояснить нахождение этой величины с помощью графиков 1 и 2 для простых реакций 1,2 и 3 порядков.
5. Написать кинетическое уравнение реакции n-порядка. Что понимают под символом «С» в этом уравнении? При каких значениях n это выражение справедливо?
6. Какие данные ДЗ-1позволяют определить, что температура Т2 изменилась по сравнению с Т1 в правильном направлении?
7. В чем суть графического метода определения порядка реакции? О чем свидетельствует вид графика 2?
8. Причины увеличения скорости реакции в присутствии катализатора.
9. Если бы заданная реакция была двусторонней, то, как изменилась бы энергия активации обратной реакции в присутствии катализатора? Ответ пояснить.
Домашнее задание № 2. «Химическая термодинамика»
Дата публикования: 2015-09-17; Прочитано: 805 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
