 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Скорость химической реакции. Скорость химического процесса - изменение концентрации вещества за единицу времени
|
|
Скорость химического процесса - изменение концентрации вещества за единицу времени.
Если в момент времени t1 концентрация реагирующего вещества была равной С1 моль/л, а в последующий момент времени С2 моль/л, то отношение

выражает среднюю скорость реакции υ за промежуток времени t2-t1 = Dt.
Чем меньше промежуток времени Dt и соответствующая ему убыль DС, тем ближе отношение 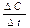 к истинной скорости реакции в соответствующий момент времени.
к истинной скорости реакции в соответствующий момент времени.
Скорость реакции всегда остается положительной. Отношение же 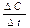 может быть как положительным, так и отрицательным. Если измеряется концентрация одного из исходных веществ, то С2 < С1 и выражение
может быть как положительным, так и отрицательным. Если измеряется концентрация одного из исходных веществ, то С2 < С1 и выражение 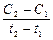 пишется со знаком минус, если же измеряется концентрация какого-либо из получающихся веществ, то выражению
пишется со знаком минус, если же измеряется концентрация какого-либо из получающихся веществ, то выражению 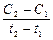 приписывают знак плюс, т.к. в этом случае С2 > С1
приписывают знак плюс, т.к. в этом случае С2 > С1
Скорость химической реакции зависит от природы реагирующих веществ, от их концентрации, от температуры, от наличия катализаторов, а также от общего давления (для реакций в газовой фазе) и от площади поверхности раздела фаз (для гетерогенных реакций).
Зависимость скорости элементарной реакции от концентрации выражается законом действия масс: скорость реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных соответствующим коэффициентам в уравнении реакции.
Так, скорость гомогенной реакции mA + nB = dC
υ = k[A]m[B]n,
где k – коэффициент пропорциональности, называемый константой скорости. Физический смысл константы скорости: k – это скорость, когда концентрации реагирующих веществ или произведение концентраций реагирующих веществ равны единице. Константа скорости зависит от природы реагирующих веществ и от температуры.
Для газообразных веществ вместо концентраций можно использовать парциальные давления.
Концентрация твердого вещества является обычно постоянной величиной и входит в константу скорости.
Так, скорость реакции
CuO(тв) + H2(г) = H2O(г) + Cu(тв)
υ = k[H2].
При увеличении температуры на 100С скорость реакции увеличивается в 2-4 раза (правило Вант-Гоффа).
Изменение скорости химической реакции с температурой характеризуется температурным коэффициентом скорости γ, который представляет собой отношение констант скоростей при температурах (Т+10) и Т: γ = kt+10/ kt или γ = υt+10/υt
Математическое выражение правила Вант-Гоффа:
υ t2/ υ t1 = γ(t2-t1)/10
Дата публикования: 2015-09-17; Прочитано: 323 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
