 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Оформлення результатів роботи. Дослід 1 і 2. Зробити висновок про стійкість суспензій та емульсій
|
|
Дослід 1 і 2. Зробити висновок про стійкість суспензій та емульсій. Що в цих системах є дисперсною фазою, а що – дисперсійним середовищем? До якого виду дисперсних систем вони належать? Як впливають мило і желатин на стійкість даних дисперсних систем? Як називаються такі речовини?
Дослід 3. Написати рівняння реакції повного гідролізу хлориду заліза, що відбувається при нагріванні, до утворення гідроксиду заліза. Скласти схему будови міцели золю гідроксиду заліза, враховуючи, що потенціал- визначальними іонами є іони заліза.
Дослід 4. Зробити висновок щодо іонів, які викликають коагуляцію. Як впливає заряд коагулюючого іону на швидкість коагуляції?
Питання для самоперевірки
1. Які системи називаються дисперсними? З чого вони складаються?
2. Чим відрізняються поняття істинний розчин і колоїдний розчин?
3. У чому проявляється кінетична та агрегативна стійкість золів? Чим вона пояснюється?
4. Якими засобами можна викликати коагуляцію колоїдного розчину?
Лабораторна робота № 12
ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Мета роботи –вивчення окисно-відновних властивостей різних речовин. Освоєння методики складання рівнянь окисно-відновних реакцій.
Загальні вказівки
При виконанні даної роботи необхідно знати, що до окисно-відновних реакцій належать реакції, які відбуваються зі зміною ступенів окиснення одного або кількох елементів, що входять до складу реагуючих речовин. Зміна ступеня окиснення зумовлена переходом або зміщенням електронів до більш електронегативного атома.
Окиснення – це процес віддачі електронів, а відновлення – приєднання електронів. Частинки, які віддають електрони, є відновниками, в процесі реакції вони окиснюються (їхній ступінь окиснення підвищується). Частинки, які приєднують електрони, є окисниками, під час реакції вони відновлюються (ступінь окиснення знижується). Елементи, які знаходяться у найвищому ступені окиснення можуть тільки відновлюватися, тому що їхні атоми спроможні лише приймати електрони: азот у ступені окиснення (+5) (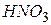 і нітрати), сірка (+6) (
і нітрати), сірка (+6) (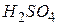 ), марганець (+7) (
), марганець (+7) (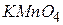 ), хром (+6) (
), хром (+6) (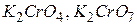 ) та ін. Елементи, які знаходяться в найнижчому ступені окиснення, можуть тільки окиснюватися, оскільки їхні атоми здатні лише віддавати електрони: сірка в ступені окиснення (-2) (
) та ін. Елементи, які знаходяться в найнижчому ступені окиснення, можуть тільки окиснюватися, оскільки їхні атоми здатні лише віддавати електрони: сірка в ступені окиснення (-2) ( і сульфіди), йод (-1) (
і сульфіди), йод (-1) (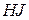 і йодиди) та ін.
і йодиди) та ін.
Речовини, які містять елементи в проміжних ступенях окиснення, мають окисно-відновну двоїстість. Вони здатні і приймати і віддавати електрони, залежно від того, з якою сполукою вони взаємодіють (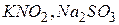 та ін.).
та ін.).
При складанні рівнянь окисно-відновних реакцій користуються двома методами підбору коефіцієнтів: методом електронного балансу і методом електронно-іонного балансу.
Метод електронного балансу дає змогу складати рівняння окисно-відновних реакцій, які відбуваються у водних розчинах, газовій та твердій фазах.
Метод електронно-іонного балансу використовують у рівняннях реакцій, які відбуваються в розчинах електролітів. У цьому випадку при визначенні коефіцієнтів у рівнянні окисно-відновної реакції виходять не із ступенів окиснення, а з реальних зарядів тих іонів, що існують у розчині.
Загальний хід складання рівнянь за обома методами однаковий. Вони різняться лише за п. 4 наведеної послідовності операцій.
1. Записати формули речовин, що вступають у реакцію.
2. Визначити, яка з них у цій реакції виявляє окисні, а яка – відновні властивості. Для цього знайти за формулами речовин ступені окиснення всіх елементів і згідно з їх положенням у періодичній системі визначити, які з них мають вищі ступені окиснення, які – нижчі.
3. Записати формули речовин, на які перетворюються окисники внаслідок відновлення, та відновники внаслідок окиснення.
4. Скласти електронні (метод електронного балансу) або електронно-іонні схеми (метод електронно-іонного балансу) процесів окиснення та відновлення. Підібрати коефіцієнти в цих схемах так, щоб загальне число електронів, які віддає відновник, дорівнювало загальному числу електронів, що приєднує окисник.
5. Розставити коефіцієнти в молекулярному рівнянні реакції так, щоб загальна кількість атомів кожного елемента була однакова в лівій і правій частинах рівняння.
Визначимо коефіцієнти за методом електронного балансу в рівнянні ре кції: 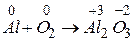

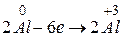 2 процес окиснення
2 процес окиснення
відновник
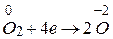 3 процес відновлення
3 процес відновлення
окисник

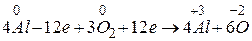
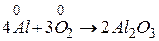
При використанні електронно-іонного балансу треба мати на увазі: якщо в напівреакції є незбалансований кисень, то надлишок кисню в лівій частині напівреакції в кислому середовищі зв’язується іонами водню з утворенням молекул води, а в нейтральних та лужних – молекулами води з утворенням гідроксид-іонів  .
.
 (кисле середовище)
(кисле середовище)
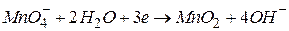 (нейтральне середовище)
(нейтральне середовище)
Нестача кисню у лівій частині напівреакції поповнюється в кислому та нейтральному середовищах киснем з молекул води, при цьому утворюються іони водню, в лужному середовищі – за рахунок гідроксид-іонів з утворенням молекул води. Наприклад:
 (нейтральне середовище)
(нейтральне середовище)
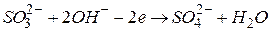 (лужне середовище)
(лужне середовище)
Визначимо коефіцієнти за методом електронно-іонного балансу в рівнянні реакції:

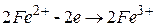 відновник
відновник
| 3 процес окиснення; |
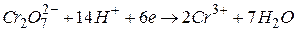 окисник
окисник
| 1 процес відновлення; |
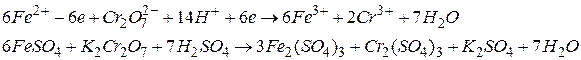
На характер перебігу окисно-відновних реакцій значно впливає середовище. Для створення кислого середовища звичайно використовують розведену 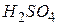 , а лужне середовище створюють, вводячи в розчин
, а лужне середовище створюють, вводячи в розчин 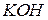 або
або 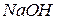 .
.
Порядок виконання роботи
Дослід 1. Окисно-відновні властивості нітриту натрію.
Узяти дві пробірки. В першу пробірку влити 3 мл розчину йодиду калію, додати декілька крапель розведеного розчину 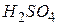 і розчин
і розчин  до змінення кольору. В другу пробірку налити 3 мл розчину
до змінення кольору. В другу пробірку налити 3 мл розчину 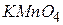 , підкислити його розведеним розчином
, підкислити його розведеним розчином 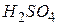 і додати розчин
і додати розчин  до утворення безбарвного розчину. Відзначити зміни.
до утворення безбарвного розчину. Відзначити зміни.
Дослід 2. Вплив  середовища на окисно-відновні реакції.
середовища на окисно-відновні реакції.
У три пробірки налити по 3 мл розчину перманганату калію. У першу додати 2 мл 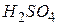 , в другу – 2 мл
, в другу – 2 мл 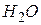 , в третю – 2 мл
, в третю – 2 мл 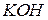 . У кожну пробірку додати по 3 мл розчину сульфіту натрію.
. У кожну пробірку додати по 3 мл розчину сульфіту натрію.
Оформлення результатів роботи
Дослід 1. Скласти рівняння окисно-відновних реакцій, використовуючи метод електронного або електронно-іонного балансу. Зробити висновок про те, в якому випадку нітрит-іони мають відновні, в якому – окисні властивості.
Дослід 2. Написати рівняння реакцій між 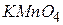 і
і 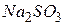 в кислому, нейтральному і лужному середовищах, враховуючи, що фіолетовий колір характерний для іонів
в кислому, нейтральному і лужному середовищах, враховуючи, що фіолетовий колір характерний для іонів 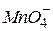 , слабо-рожевий, майже безбарвний - для іонів
, слабо-рожевий, майже безбарвний - для іонів 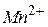 , зелений – для іонів
, зелений – для іонів 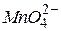 , бурий колір має осад
, бурий колір має осад 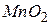 . Зробити висновок щодо впливу
. Зробити висновок щодо впливу 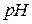 середовища на глибину перебігу окисно-відновних процесів.
середовища на глибину перебігу окисно-відновних процесів.
Питання для самоперевірки
1. Які реакції називаються окисно-відновними?
2. Що таке ступінь окиснення?
3. Що таке окисник і відновник?
4. Які сполуки мають окисно-відновну двоїстість?
5. Для яких реакцій використовують методи електронного та електронно-іонного балансів?
Лабораторна робота № 13
Дата публикования: 2015-09-18; Прочитано: 234 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
